
Kiedy zagraniczny zakład zajmuje się produkcją wyrobów medycznych importowanych do Stanów Zjednoczonych (US), obowiązkowe jest wyznaczenie US dla tego zakładu. US pełni funkcję osoby kontaktowej w sprawach związanych z komunikacją US Agencją US i Leków (US FDA) dotyczącą zagranicznego zakładu. Ponieważ komunikacja ta może mieć charakter pilny, US musi posiadać kompleksową wiedzę na temat FDA US FDA i być w stanie doradzać zagranicznemu zakładowi w zakresie zgodności z wymogami US FDAwyrobów medycznych. Ponadto posiadanie niezależnego US pomaga zapobiegać potencjalnym konfliktom interesów, które mogą powstać, gdy partner biznesowy zostaje wyznaczony jako US . W tym blogu omówimy szczegółowo rejestrację zagranicznego zakładu w US FDA.
Czym jest rejestracja zakładu?
Coroczna rejestracja w US agencjiFDA obowiązkowa dla producentów kontraktowych, importerów początkowych, podmiotów zajmujących się przepakowywaniem/ponownym etykietowaniem, podmiotów opracowujących specyfikacje itp. z zakładów zajmujących się produkcją i dystrybucją wyroby medyczne na rynek amerykański. Procedura ta nosi nazwę rejestracji zakładu (tytuł 21 CFR część 807).
Who musi złożyć wniosek o rejestrację zakładu?
Właściciele zakładów zajmujących się produkcją i dystrybucją wyroby medyczne do użytku w US dokonać corocznej rejestracji w US agencjiFDA. O rejestrację zakładu mogą ubiegać się następujące rodzaje właścicieli:
- Właściciele lokali mieszkalnych
- Właściciele zakładów zagranicznych
- Producenci kontraktowi
- Początkowi importerzy
- Podmioty zajmujące się przepakowywaniem/etykietowaniem
- Twórcy specyfikacji
Jakie są etapy procesu rejestracji firmy?
Aby zarejestrować zakład produkujący wyroby medyczne w US agencjiFDA, należy postępować zgodnie z instrukcjami przedstawionymi na poniższym schemacie.
Rysunek 1: Etapy procesu rejestracji przedsiębiorstwa
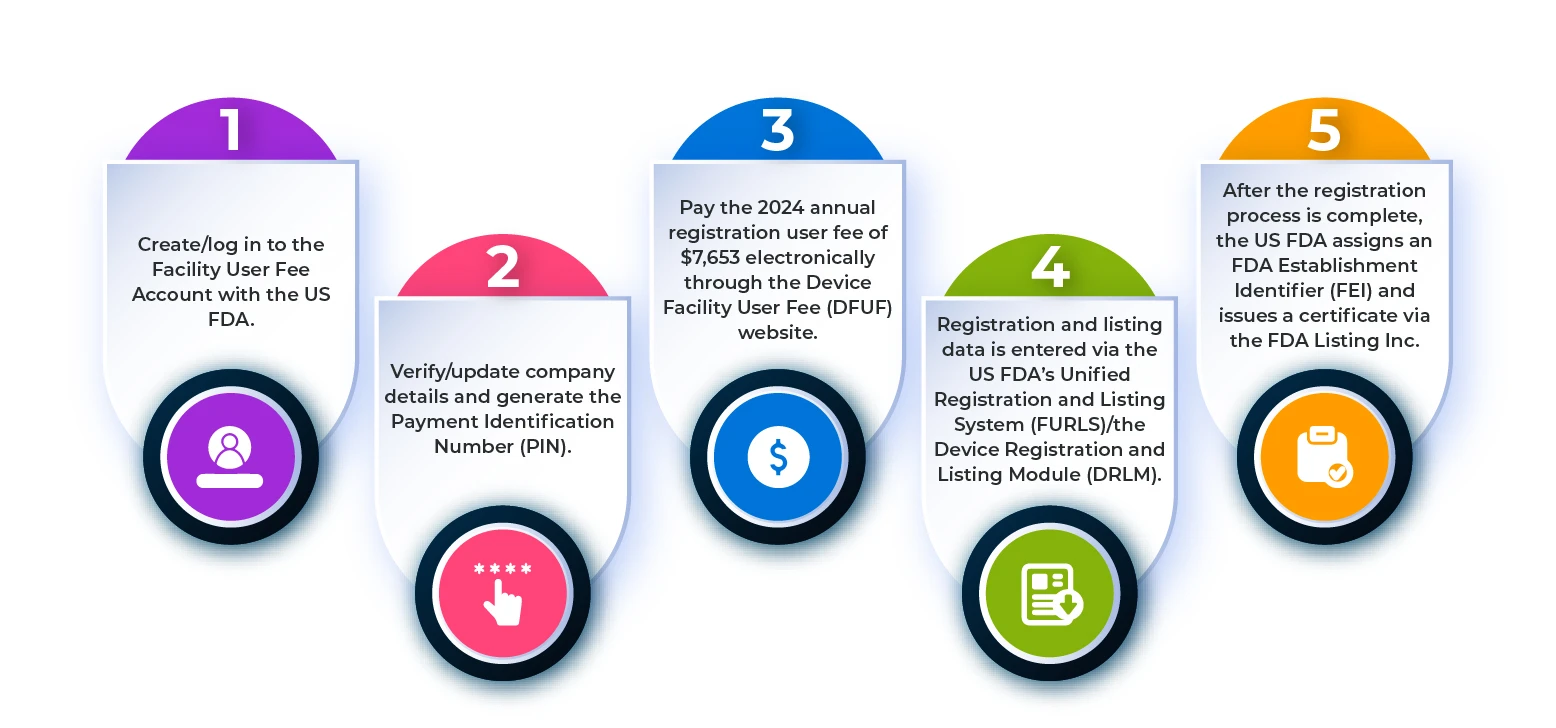
Jakie są wymogi dotyczące rejestracji i notowania zagranicznych zakładów?
Zrozumienie znaczenia wyboru niezależnego, doświadczonego US pomoże zagranicznym podmiotom nadać priorytet unikaniu wszelkich konfliktów interesów, co ma ogromne znaczenie dla podmiotów poruszających się w skomplikowanej dziedzinie FDA US FDA . Zagraniczne przedsiębiorstwa muszą pogłębić swoją wiedzę na temat warunków koniecznych do osiągnięcia zgodności, nawiązać silne partnerstwa z US i stworzyć warunki do sprawnego procesu rejestracji. Poniższa tabela przedstawia wymagania dotyczące rejestracji i wpisania do rejestru w oparciu o działalność zagranicznego przedsiębiorstwa. Wskazuje również, które działania wiążą się z opłatą rejestracyjną dla przedsiębiorstwa.
Tabela 1: Wymogi dotyczące rejestracji i notowania w oparciu o działalność zakładu zagranicznego
| Aktywność | Rejestr | Lista | Opłata | |
| Producent kontraktowy (w tym pakowacze kontraktowi) | TAK 807.40 (a) | TAK 807.40 (a) | TAK | |
| Sterylizator kontraktowy | TAK 807.40 (a) | TAK 807.40 (a) | TAK | |
| Producenci urządzeń niestandardowych | TAK 807.20 (a) (2) | TAK 807.20 (a) (2) | TAK | |
| Urządzenie badane w ramach wyłączenia dla urządzeń badawczych (IDE) | NO 812.1 (a) | NO 812.1(a),807.40 (c) | NIE | |
| Zagraniczny eksporter urządzeń zlokalizowanych w obcym kraju | TAK 807.40 (a) | TAK 807.40 (a) | TAK | |
| Producenci zagraniczni (w tym montażyści zestawów) | TAK 807.40 (a) | TAK 807.40 (a) | TAK | |
| Prowadzenie akt skarg zgodnie z wymogami 21 CFR 820.198 | TAK | TAK | TAK | |
| Producent akcesoriów, które są pakowane lub etykietowane w celu komercyjnej dystrybucji do celów związanych ze zdrowiem dla użytkownika końcowego | TAK 807.20 (a) (5) | TAK 807.20 (a) (5) | TAK | |
| Producent komponentów, które są dystrybuowane wyłącznie do producenta gotowych urządzeń | NIE 807.65 (a) | NIE | NIE | |
| Firmy zajmujące się ponownym etykietowaniem lub przepakowywaniem | TAK 807.20 (a) (3) | TAK 807.20 (a) (3) | TAK | |
| Producent | TAK | TAK | TAK | |
| Reprocesor urządzenia jednorazowego użytku | TAK 807.20 (a) | TAK 807.20 (a) | TAK | |
| Twórcy specyfikacji | TAK | TAK | TAK | |
Rejestracja zakładu w US agencjiFDA niezbędnym wymogiem dla zagranicznych zakładów zajmujących się produkcją, sprzedażą, przepakowywaniem lub importem wyroby medyczne Stanach US. Rejestracja ta gwarantuje zgodność z surowymi przepisami i normami US FDA. Freyr zapewnia cenne wsparcie dla podmiotów poszukujących fachowego doradztwa podczas procesu rejestracji. Wykorzystując swoją wiedzę i zrozumienie przepisów US FDA, Freyr pomaga zagranicznym podmiotom w spełnieniu wymogów zgodności, co ostatecznie prowadzi do płynniejszego i bardziej efektywnego wejścia na rynek wyrobów US . Aby dowiedzieć się więcej o procesie rejestracji podmiotów w US agencjiFDA, reach z nami już dziś. Bądź na bieżąco! Dbaj o zgodność z przepisami!









