
Oprogramowanie urządzeń medycznych w Korei Południowej jest wykorzystywane do diagnozowania, leczenia i monitorowania pacjentów w nowoczesnym systemie opieki zdrowotnej. Obejmuje ono zarówno oprogramowanie wbudowane, zintegrowane z wyroby medyczne oprogramowanie samodzielne, które może być wykorzystywane na komputerach osobistych, urządzeniach mobilnych i w usługach internetowych. Ministerstwo Bezpieczeństwa Żywności i Leków (MFDS) w Korei Południowej jest odpowiedzialne za regulację oprogramowania urządzeń medycznych oraz zapewnienie jego bezpieczeństwa i skuteczności. W dniu 5 lipca 2023 r. MFDS określiło kryteria zatwierdzania i kontroli oprogramowania urządzeń medycznych; przepisy te stanowią strukturę, którą mogą stosować wnioskodawcy cywilni przy składaniu wniosków o zatwierdzenie lub przegląd oprogramowania.
Przepisy dotyczą różnych zagadnień, w tym zakresu zastosowania, wymagań dotyczących dokumentacji technicznej oraz raportów z weryfikacji zgodności. Oprócz wytycznych MFDS istnieją międzynarodowe normy i wytyczne mające zastosowanie do oprogramowania urządzeń medycznych, takie jak norma Międzynarodowej Komisji Elektrotechnicznej (IEC) 62304 dotycząca procesów cyklu życia oprogramowania oraz wytyczne Amerykańskiej Agencji ds. Żywności i Leków (US FDA) dotyczące mobilnych aplikacji medycznych.
Plan rozwoju oprogramowania i analiza wymagań
- Plan rozwoju oprogramowania określa ogólne podejście do rozwoju oprogramowania, w tym specyfikacje, metody i narzędzia programistyczne. Obejmuje on również weryfikację, zarządzanie ryzykiem związanym z wyrobami medycznymi, zarządzanie konfiguracją i dokumentację.
- Analiza wymagań określa wymagania dotyczące oprogramowania urządzeń medycznych, w tym środki kontroli ryzyka i metody weryfikacji. Starannie planując i analizując proces tworzenia oprogramowania, programiści mogą zapewnić, że powstałe oprogramowanie spełnia niezbędne standardy bezpieczeństwa i skuteczności.
- Raport weryfikacji zgodności oprogramowania zawiera zarys planu rozwoju oprogramowania, numer kontrolny dokumentu producenta oraz przegląd analizy wymagań. Przestrzegając tych wytycznych, oprogramowanie dla urządzeń medycznych może być tworzone z pewnością, wiedząc, że przeszło rygorystyczne testy i spełnia niezbędne standardy bezpieczeństwa i skuteczności.
Weryfikacja i walidacja oprogramowania urządzeń medycznych
- Weryfikacja oprogramowania urządzeń medycznych zapewnia, że oprogramowanie spełnia określone wymagania.
- Walidacja oprogramowania urządzeń medycznych zapewnia, że oprogramowanie spełnia potrzeby użytkownika i zamierzone zastosowania.
- Raport z weryfikacji i walidacji oprogramowania urządzenia medycznego przedstawia proces weryfikacji i walidacji, w tym nazwę produktu, wersję oraz nazwiska osób who zbadały i zatwierdziły raport. Raport może się różnić w zależności od charakterystyki oprogramowania, ale powinien zawierać opis oprogramowania, zastosowane metody weryfikacji i walidacji oraz wyniki testów.
Środowisko operacyjne i oprogramowanie o nieznanym pochodzeniu (SOUP)
- Jeśli oprogramowanie jest zależne od określonego sprzętu, takiego jak oprogramowanie wbudowane, dokument techniczny powinien opisywać specyfikacje sprzętowe.
- Jeśli jednak oprogramowanie jest samodzielne i opracowane do pracy na sprzęcie ogólnego przeznaczenia, środowisko operacyjne musi być opisane w surowych materiałach. Obejmuje to minimalne zalecane specyfikacje, takie jak Microsoft Windows 10 lub nowszy.
- Dodatkowo, jeśli oprogramowanie urządzenia medycznego zawiera komercyjne oprogramowanie o nieznanym pochodzeniu (SOUP), należy utworzyć środowisko operacyjne w celu zapewnienia prawidłowego funkcjonowania. Starannie opisując środowisko operacyjne i odnosząc się do wszelkich SOUP, programiści mogą zapewnić, że ich oprogramowanie urządzeń medycznych jest bezpieczne i skuteczne zgodnie z przeznaczeniem.
Zarządzanie ryzykiem związanym z urządzeniami medycznymi i wymogi dotyczące dokumentacji
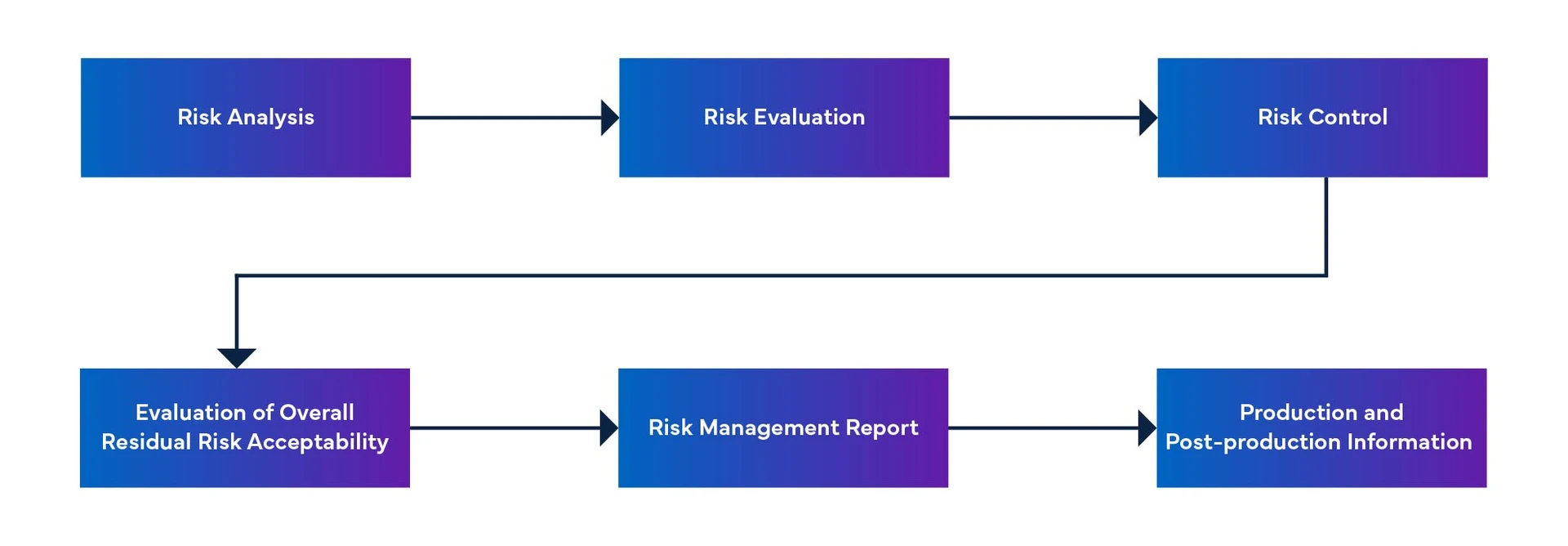
- Proces zarządzania ryzykiem związanym z software as a medical device obejmuje identyfikację niebezpiecznych sytuacji, ustanowienie środków kontroli ryzyka, weryfikację tych środków i zarządzanie zmianami oprogramowania.
- Dokument dotyczący zarządzania ryzykiem oprogramowania MFDS-RM zawiera informacje na temat zarządzania ryzykiem oprogramowania.
- Ponadto wymagania dotyczące dokumentacji są niezbędne, aby zapewnić, że oprogramowanie spełnia niezbędne standardy bezpieczeństwa i skuteczności.
- Dokumentacja musi zawierać plan rozwoju oprogramowania, analizę wymagań oprogramowania dla urządzeń medycznych oraz raporty z weryfikacji i walidacji oprogramowania.
- Raport z Weryfikacji Zgodności Oprogramowania określa wymagania dotyczące dokumentacji; zawiera również zarys odpowiednich dokumentów i numer kontrolny dokumentu producenta.
Rysunek 1: Proces zarządzania ryzykiem związanym z urządzeniami medycznymi
Nierozwiązane anomalie i działania naprawcze dla oprogramowania SaMD
- Dokument MFDS-PR (rozwiązywanie problemów z oprogramowaniem) przedstawia proces rozwiązywania problemów z oprogramowaniem, który obejmuje zgłaszanie problemów, analizę, wdrażanie i weryfikację.
- Dokument zawiera również listę nierozwiązanych problemów, błędów, usterek i anomalii, a także ocenę ryzyka szczątkowego dla systemu oprogramowania.
- Działania naprawcze podjęte w celu rozwiązania tych kwestii muszą być udokumentowane w planie konserwacji oprogramowania, który jest ustalany zgodnie z procesem konserwacji oprogramowania.
- Dokument dotyczący konserwacji MFDS zawiera informacje na temat SaMD i rozwiązywania problemów.
Wymagania dotyczące przeglądu i składania dokumentów technicznych dla oprogramowania SaMD
Głównymi dokumentami przeglądowymi w procesie przeglądu są dane dotyczące wydajności, raport potwierdzenia zgodności oraz dane dotyczące weryfikacji i walidacji oprogramowania urządzenia medycznego, specyfikacja projektu oprogramowania (SDS), oświadczenie o wymaganiach dotyczących oprogramowania urządzenia medycznego (SRS) oraz raporty z weryfikacji i walidacji. Należy przedłożyć raport potwierdzenia zgodności oraz raport weryfikacji i walidacji oprogramowania urządzenia medycznego.
Zarządzanie ryzykiem związanym z oprogramowaniem urządzeń medycznych
- Identyfikacja potencjalnych zagrożeń związanych z oprogramowaniem i jego użytkowaniem.
- Ocena stopnia ryzyka związanego z tymi zagrożeniami.
- Wdrożenie środków kontroli ryzyka w celu zminimalizowania prawdopodobieństwa wystąpienia szkody.
- Monitorowanie i przegląd skuteczności tych środków kontroli ryzyka.
- Dokumentowanie wszystkich działań i decyzji w zakresie zarządzania ryzykiem związanym z urządzeniami medycznymi.
W systemie oprogramowania elementy oprogramowania są podzielone na mniejsze części, w tym szczegółowe elementy oprogramowania. Gdy element nie może być dalej podzielony, nazywany jest jednostką. System umożliwia podział do poziomu jednostki, pomagając określić poziom bezpieczeństwa dla każdego elementu oprogramowania. Łącząc te elementy oprogramowania razem, jesteśmy w stanie określić poziom bezpieczeństwa dla całego systemu oprogramowania.
Rysunek 2: Demontaż i integracja oprogramowania urządzenia medycznego
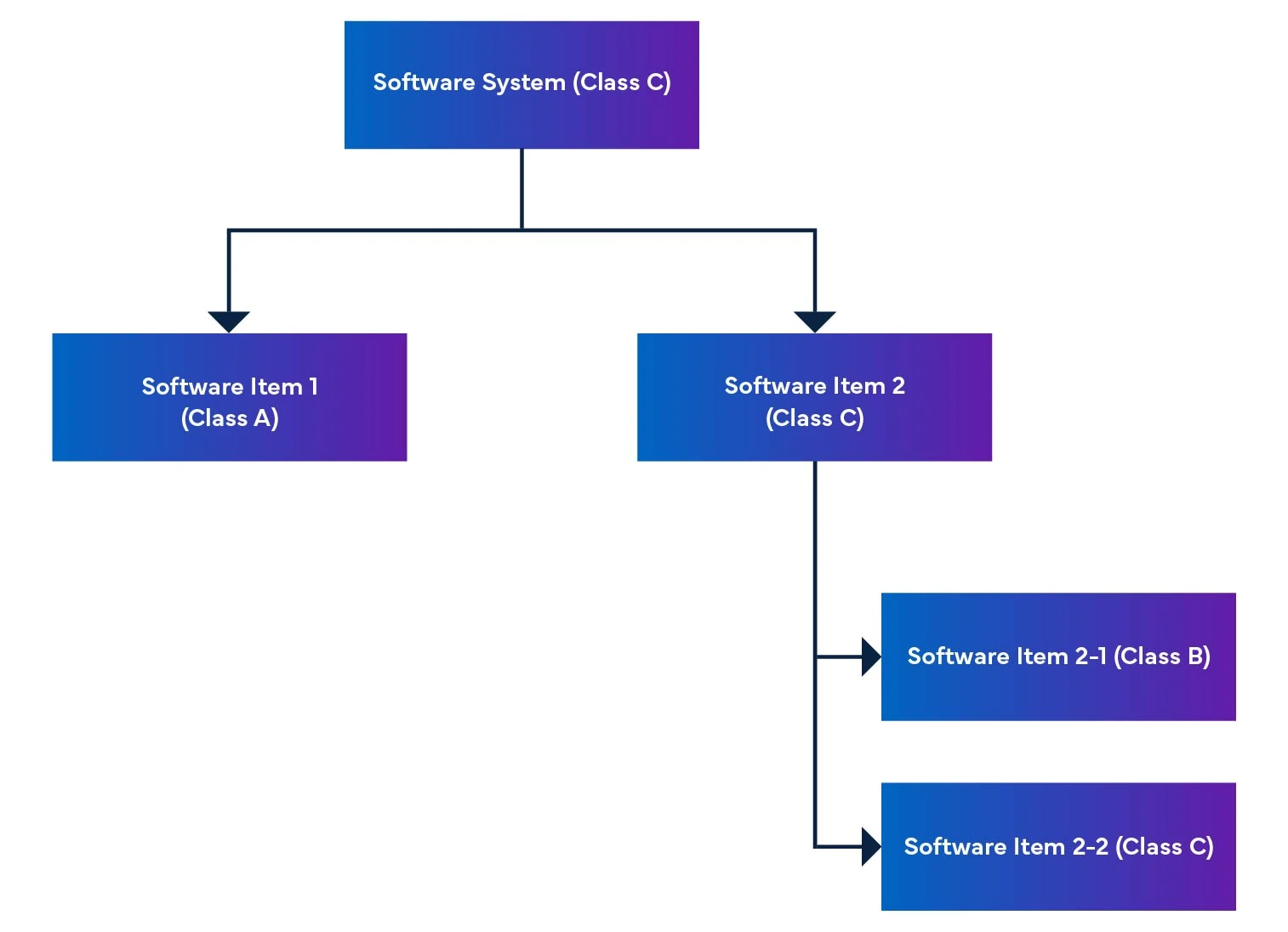
Rozporządzenie wspomina również o ocenie bezpieczeństwa oprogramowania, która jest oceną służącą do identyfikacji ryzyka związanego z oprogramowaniem SaMD (patrz Tabela 1).
Tabela 1: Definicja oceny bezpieczeństwa
| Ocena | Definicja klasy bezpieczeństwa oprogramowania urządzeń medycznych |
| Klasa A | Brak możliwości zranienia lub uszkodzenia ciała. |
| Klasa B | Prawdopodobne są mniej poważne obrażenia (drobne urazy). |
| Klasa C | Możliwość odniesienia poważnych obrażeń lub śmierci. |
Zarządzanie konfiguracją oprogramowania
- Prowadzenie dokładnej i aktualnej dokumentacji dla wszystkich wersji oprogramowania, zmian i aktualizacji.
- Zapewnienie, że cała dokumentacja jest odpowiednio sprawdzona i zatwierdzona.
- Wdrożenie procedur zarządzania zmianami konfiguracji oprogramowania.
- Dokumentowanie wszystkich działań i decyzji związanych z zarządzaniem konfiguracją oprogramowania.
Konserwacja oprogramowania
- Regularne testowanie i monitorowanie oprogramowania w celu zapewnienia, że pozostaje ono bezpieczne i skuteczne zgodnie z przeznaczeniem.
- Wdrażanie procedur rozwiązywania wszelkich problemów, które mogą się pojawić, w tym poprawek błędów i aktualizacji oprogramowania.
- Dokumentowanie wszystkich działań i decyzji związanych z konserwacją oprogramowania.
Rozwiązywanie problemów
- Identyfikacja przyczyny źródłowej problemu.
- Wdrożenie działań naprawczych w celu rozwiązania problemu.
- Dokumentowanie całego procesu rozwiązywania problemów do wykorzystania w przyszłości.
Postępując zgodnie z powyższymi wytycznymi, deweloperzy mogą zapewnić, że wszelkie kwestie związane z ich oprogramowaniem dla urządzeń medycznych zostaną odpowiednio rozwiązane i udokumentowane, a oprogramowanie spełni wymagania niezbędne do zatwierdzenia lub zbadania.
Jeśli jesteś producentem urządzeń medycznych, którego celem jest zapewnienie zgodności z południowokoreańskimi standardami oprogramowania dla urządzeń medycznych, eksperci Freyrds. regulacji mogą przeprowadzić Cię przez zawiły krajobraz regulacyjny tego kraju. Zapewnimy, że Twoje urządzenia będą zgodne z najnowszymi południowokoreańskimi przepisami dotyczącymi urządzeń medycznych. Skontaktuj się us, aby dowiedzieć się więcej!









