„Urządzenie referencyjne” to wyrób medyczny, który został wcześniej zatwierdzony przez US Agencję US i Leków (FDA) i jest już dostępny na rynku, służący jako punkt odniesienia dla nowych wyroby medyczne zatwierdzenie w ramach procedury FDA510(k).
Należy udowodnić, że przedmiotowy wyrób jest co najmniej tak samo bezpieczny i skuteczny jak wyrób źródłowy pod względem jego zamierzonego zastosowania i właściwości technologicznych. Porównanie to znane jest jako określenie "istotnej równoważności".
Nowe urządzenie nie musi być identyczne z urządzeniem-kandydatem, aby było zasadniczo równoważne z urządzeniem-kandydatem.
Jak zidentyfikować urządzenie źródłowe?
Baza FDAzawiera trzyliterowy kod produktu dla każdej klasyfikacji urządzenia. Baza danych FDA (k) zawiera informacje o wszystkich urządzeniach zatwierdzonych wprocesie 510(k). Po uzyskaniu trzyliterowego kodu produktu można uzyskać listę wszystkich produktów, wszystkich firm oraz nazw handlowych wszystkich konkurentów lub potencjalnych konkurentów, których chcesz sprawdzić. Następnie można przeprowadzić dogłębną analizę i porównanie, aby zawęzić wybór urządzenia referencyjnego.
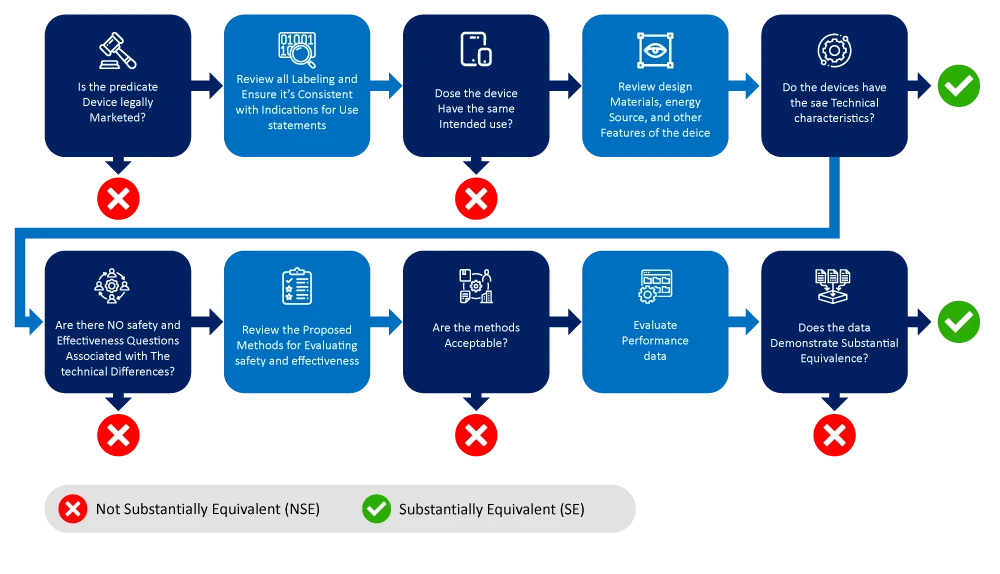
Poniżej znajduje się schemat blokowy przedstawiający proces identyfikacji i zawężania wyboru urządzenia referencyjnego.
Czynniki, które należy wziąć pod uwagę przy określaniu urządzeń predykcyjnych
- Zamierzone zastosowanie: Zamierzone zastosowanie urządzenia źródłowego powinno być podobne do zastosowania nowego urządzenia. Na przykład, jeśli nowe urządzenie jest przeznaczone do monitorowania pracy serca, urządzenie źródłowe również powinno być urządzeniem do monitorowania pracy serca.
- Charakterystyka technologiczna: Urządzenie predykatowe powinno być identyczne z nowym urządzeniem pod względem cech technologicznych. Weźmy na przykład projekt, użyte materiały i metodę działania, które powinny być podobne.
- Biokompatybilność: Ocena biokompatybilności wyrobu medycznego lub komponentu nie powinna ograniczać się do surowców wykorzystywanych w wyrobie i procesie produkcyjnym, należy również wziąć pod uwagę dodatkowe substancje chemiczne. Czynnik ten nie ma jednak zastosowania do urządzeń IVD.
- Najnowsza technologia: Urządzenie predicate nie powinno być przestarzałe i powinno reprezentować najnowszą technologię medyczną.
Urządzenie referencyjne jest kluczowym czynnikiem decydującym o tym, czy nowe urządzenie medyczne może zostać wprowadzone na rynek w ramach ścieżki 510(k). Wybór nieodpowiedniego urządzenia referencyjnego może skutkować droższym i bardziej czasochłonnym procesem zatwierdzania przez organy regulacyjne, podczas gdy wybór właściwego urządzenia referencyjnego może pomóc w zmniejszeniu kosztów i czasu wymaganych do wprowadzenia nowego wyrobu medycznego na rynek. Jeśli urządzenie referencyjne nie jest odpowiednie, może to skutkować opóźnieniami i dodatkowymi kosztami.
Aby uzyskać pomoc w procesie składania wniosku 510(k) dotyczącego urządzenia medycznego, umów się na rozmowę telefoniczną z ekspertami Freyr , którzy pomogą Ci przejść przez procedury. Bądź na bieżąco. Zachowaj zgodność z przepisami.









