
Rozporządzenie Unii Europejskiej (UE) w sprawie wyrobów medycznych (MDR) od pewnego czasu jest przedmiotem zainteresowania mediów. Rozporządzenie MDR zastąpiło dyrektywę w sprawie wyrobów medycznych (MDD) oraz dyrektywę w sprawie aktywnych wyrobów medycznych do implantacji (AIMDD). Początkowo planowano, że całe przejście wejdzie w życie w maju 2020 r., jednak ze względu na pandemię COVID-19 termin wdrożenia został przesunięty na 26 maja 2021 r. Zgodnie z tym harmonogramem do 26 maja 2024 r. wszystkie certyfikaty MDD staną się nieważne, a producenci wyrobów będą musieli dostosować się do EU MDR rozporządzenia EU MDR. Ponadto urządzenia MDD wprowadzone legalnie do obrotu zgodnie z dyrektywami 90/385/EWG i 93/42/EWG przed 26 maja 2020 r. oraz urządzenia wprowadzone do obrotu od 26 maja 2020 r. na podstawie certyfikatu będą nadal dostępne na rynku do 27 maja 2025 r. Harmonogram przedstawiono poniżej –
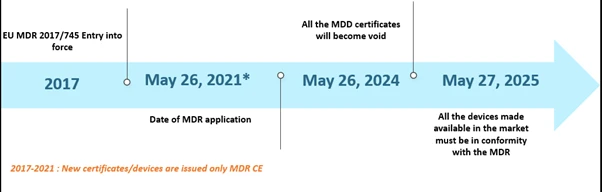
Harmonogramy scenariuszy dotyczących rozporządzenia EU MDR )
Jednakograniczone możliwości jednostek notyfikowanych (NB) oraz nieprzygotowanie producentów stanowiły pewne wyzwanie dla wdrożenia MDR zgodnie z wyznaczonym harmonogramem. Na październik 2022 r. istnieje łącznie trzydzieści osiem (38) jednostek notyfikowanych (NB), które otrzymały około 8120 wniosków o EU MDR , z czego wydano 1990 certyfikatów. Zgodnie z ich szacunkami dotyczącymi pierwotnego harmonogramu można było przetworzyć tylko 7000 certyfikatów, co dodatkowo doprowadziło do przedłużenia harmonogramu. Ponadto jedną z innych prawdopodobnych przyczyn przedłużenia terminu było zapewnienie ciągłej dostępności bezpiecznych wyroby medyczne certyfikaty już wygasły lub wygasną przed 26 maja 2024 r. Obecny scenariusz przedłużonego harmonogramu przedstawiono poniżej.
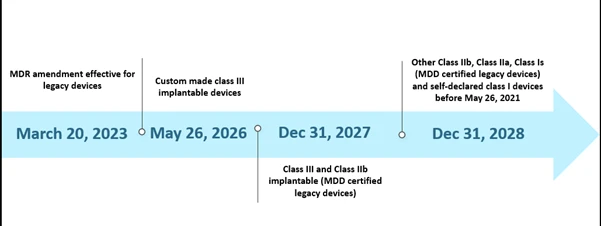
Harmonogramy scenariuszy dotyczących rozporządzenia EU MDR )
Nowe rozszerzenie ma zastosowanie do starszych urządzeń spełniających wymogi art. 120 (3e) z ważną dyrektywą MDD CE lub odstępstwem na dzień 20 marca 2023 r. i pozostanie na rynku wraz z urządzeniami z oznakowaniem MDR CE. Do 26 maja 2024 r. producenci starszych urządzeń powinni wdrożyć system zarządzania jakością i złożyć wniosek o ocenę zgodności w wyznaczonej przez MDR jednostce certyfikującej, a do 26 września 2024 r. producenci starszych urządzeń powinni zawrzeć umowę z wyznaczoną przez MDR jednostką certyfikującą.
Przyjrzyjmy się teraz wpływowi tego rozszerzenia na producentów.
Możliwości, jakie producenci mają dzięki temu rozszerzeniu:
- Rozszerzony dostęp do rynku dla producentów urządzeń posiadających certyfikaty MDD/AIMDD, którzy podjęli już działania mające na celu zapewnienie zgodności z MDR.
- Producenci z certyfikatem MDR, których certyfikaty MDD/AIMDD CE nie zostały cofnięte, mogą wprowadzać starsze urządzenia na rynek do końca okresu przejściowego, oprócz urządzeń zgodnych z MDR.
- Producenci, którzy posiadają krajowe odstępstwo od dnia 20 marca 2023 r., mogą skorzystać z okresu przejściowego.
- Okres przedłużenia daje więcej czasu na lepsze zrozumienie zasad i przepisów, co pomaga usprawnić proces i osiągnąć zgodność z MDR.
Wyzwania, które mogą pojawić się przed producentami w związku z tym rozszerzeniem:
- Producenci starszych urządzeń, którzy nie chcieli dostosować się do MDR, nie odnoszą żadnych korzyści rynkowych.
- Rozszerzenie MDR może spowodować przeciąganie się procesów certyfikacji i opóźniać wprowadzanie produktów na rynek, co jest bezpośrednim skutkiem zaległości w przeglądach dokonywanych przez NB.
Jakie działania powinni podjąć producenci?
- Konieczne jest, aby producenci określili klasę ryzyka MDR swojego wyrobu medycznego, aby szybko zidentyfikować odpowiedni okres przejściowy zgodnie ze zmienionymi przepisami MDR.
- Aby zapewnić zgodność z przepisami MDR, kluczowe jest zidentyfikowanie i zainicjowanie komunikacji z wyznaczonymi przez MDR jednostkami certyfikującymi posiadającymi określone kompetencje wymagane do klasyfikacji danego wyrobu medycznego.
- Kluczowe znaczenie ma przeprowadzenie kompleksowej oceny luk dla urządzenia medycznego certyfikowanego zgodnie z MDD/AIMDD, zidentyfikowanie i usunięcie wszelkich niezgodności z przepisami MDR oraz zapewnienie terminowej zgodności.
Producenci muszą podjąć natychmiastowe działania, aby zapewnić zgodność z MDR. Wydłużony termin daje producentom pewne możliwości osiągnięcia zgodności z MDR, ale stwarza również wyzwania, takie jak opóźnienia w procesach certyfikacji i koszty związane z zapewnieniem zgodności. Aby sprostać tym wyzwaniom i wykorzystać możliwości, pozwól naszemu zespołowi profesjonalistów pomóc Ci w procesie zapewnienia zgodności z MDR i zapewnić Ci sukces w tym trudnym środowisku regulacyjnym. Umów się z us na spotkanie us , aby dowiedzieć się więcej o tym, jak możemy pomóc Ci osiągnąć zgodność z MDR i wyprzedzić konkurencję. Bądź na bieżąco. Zachowaj zgodność z przepisami.









