
Jaka jest rola cyberbezpieczeństwa w wyroby medyczne?
Proces zatwierdzania 510(k)to ścieżka regulacyjna stosowana przez Amerykańską Agencję ds. Żywności i Leków (US FDA) w celu oceny i zatwierdzenia komercyjnej dystrybucji wyroby medyczne. Proces ten ma na celu zapewnienie, że wyroby medyczne bezpieczne i skuteczne w stosowaniu przez pacjentów. US FDA cyberbezpieczeństwo jako „proces zapobiegania nieuprawnionemu dostępowi, modyfikacji, niewłaściwemu wykorzystaniu lub odmowie dostępu lub nieuprawnionemu wykorzystaniu informacji przechowywanych, udostępnianych lub przekazywanych z wyrobu medycznego do zewnętrznego odbiorcy”.
wyroby medyczne coraz częściej podłączane do sieci, przez co są narażone na zagrożenia związane z cyberbezpieczeństwem, takie jak hakowanie, naruszenia danych i ataki złośliwego oprogramowania. Zajęcie się kwestią cyberbezpieczeństwa na etapie projektowania i rozwoju ma kluczowe znaczenie dla zapewnienia odpowiednich wyroby medyczne bezpieczeństwa wyroby medyczne . Zagrożeń i słabych punktów nie da się całkowicie wyeliminować, a ograniczenie ryzyka związanego z cyberbezpieczeństwem jest szczególnie trudnym zadaniem. Nieodpowiednie zabezpieczenie cyberbezpieczeństwa może prowadzić do utraty funkcjonalności urządzeń, utraty danych osobowych lub medycznych oraz rozprzestrzeniania się zagrożeń bezpieczeństwa na inne połączone sieci lub urządzenia.
Incydenty spowodowane naruszeniem cyberbezpieczeństwa
Incydenty związane z cyberbezpieczeństwem spowodowały, że wyroby medyczne sieci szpitalne przestały działać, co doprowadziło do zakłóceń w świadczeniu opieki nad pacjentami w placówkach opieki zdrowotnej w US. Takie cyberataki i exploity mogą również prowadzić do szkód dla pacjentów z powodu zagrożeń klinicznych, na przykład opóźnień w diagnozowaniu i/lub leczeniu pacjentów.
Poniżej wymieniono kluczowe incydenty w sektorze opieki zdrowotnej, które podkreślają znaczenie cyberbezpieczeństwa dla bezpieczeństwa pacjentów.
- W 2017 r. atak ransomware WannaCry dotknął systemy szpitalne i wyroby medyczne świecie.
- W 2020 r. atak ransomware na niemiecki szpital uwypuklił potencjalne osiemdziesiąt trzy (83) skutki opóźnionej opieki nad pacjentem, ponieważ atak zmusił pacjentów do przekierowania do innego szpitala.
Kluczowe kwestie związane z cyberbezpieczeństwem w procesie zatwierdzania 510(k)
Poniżej przedstawiono ogólne zasady dotyczące cyberbezpieczeństwa dla producentów urządzeń medycznych, zgodnie z wytycznymi US FDA , które odnoszą się do wniosków przed wprowadzeniem produktu na rynek.
- Przepisy dotyczące systemu jakości (QSR):Producenci powinni zająć się kwestiami cyberbezpieczeństwa na etapie projektowania i rozwoju wyrobu medycznego, ponieważ może to skutkować bardziej skutecznym i wydajnym ograniczaniem ryzyka dla pacjentów. Producenci powinni ustanowić wymagania projektowe związane z cyberbezpieczeństwem dla swoich wyrobów oraz podejście do zarządzania podatnością na zagrożenia cyberbezpieczeństwa w ramach walidacji oprogramowania i analizy ryzyka wymaganej przez 21 CFR 820.30(g).
- Bezpieczeństwo projektowe:Producenci urządzeń muszą zapewnić, że ich produkty są projektowane z uwzględnieniem bezpieczeństwa urządzeń. US agencjaFDA adekwatność zabezpieczeń na podstawie zdolności urządzenia do zapewnienia i wdrożenia celów bezpieczeństwa, takich jak autentyczność, autoryzacja, dostępność, poufność i bezpieczeństwo oraz możliwość aktualizacji w odpowiednim czasie w całej architekturze systemu.
- Przejrzystość: Brak informacji dotyczących cyberbezpieczeństwa na urządzeniu, takich jak informacje niezbędne do zintegrowania urządzenia ze środowiskiem użytkowania, a także informacje potrzebne użytkownikom do utrzymania cyberbezpieczeństwa w całym cyklu życia urządzenia, może potencjalnie wpływać na jego bezpieczeństwo i skuteczność. Aby rozwiać te obawy, ważne jest, aby użytkownicy urządzeń mieli dostęp do informacji dotyczących kontroli cyberbezpieczeństwa, potencjalnych zagrożeń i innych istotnych informacji.
- Dokumentacja zgłoszeniowa: Oczekuje się, że projekt i dokumentacja cyberbezpieczeństwa urządzenia będą skalowane wraz z ryzykiem cyberbezpieczeństwa urządzenia. Producenci powinni wziąć pod uwagę większy system, w którym urządzenie może być używane.
Rysunek 1: Typowe wyzwania i rozwiązania w zakresie cyberbezpieczeństwa 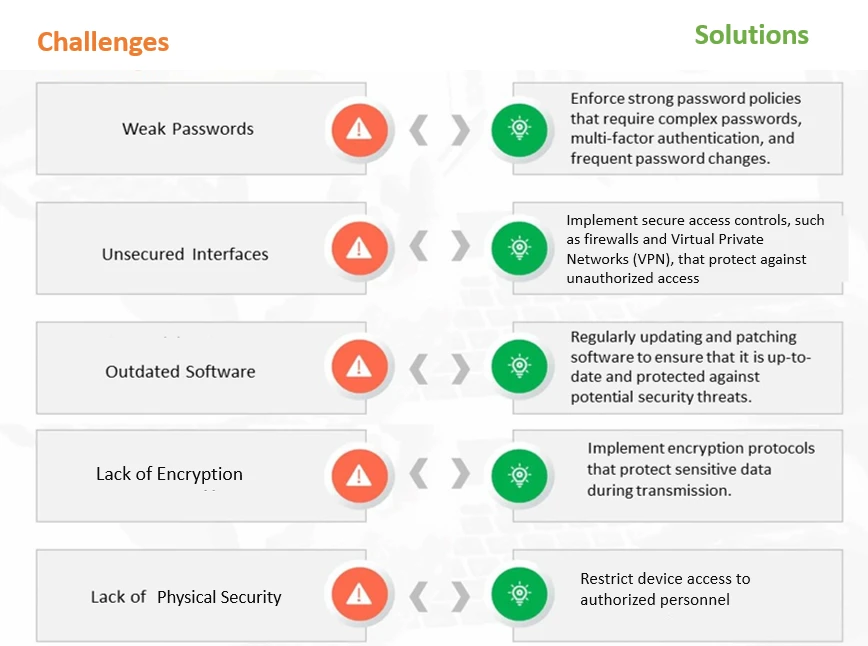
Wnioski
Podsumowując, cyberbezpieczeństwo wyroby medyczne kluczowe wyroby medyczne dla zapewnienia bezpieczeństwa pacjentów i zapobiegania incydentom, które mogą zakłócić świadczenie usług medycznych. US przepisyFDA podkreślają konieczność uwzględnienia przez producentów kwestii cyberbezpieczeństwa podczas projektowania i opracowywania wyroby medyczne zapewnienia przejrzystych informacji na temat środków kontroli cyberbezpieczeństwa. QSR, bezpieczeństwo projektu, przejrzystość i dokumentacja zgłoszeniowa są kluczowymi czynnikami branymi pod uwagę przy wydawaniu zezwolenia 510(k). Ważne jest również zajęcie się typowymi wyzwaniami związanymi z cyberbezpieczeństwem, takimi jak podatność komponentów stron trzecich i ataki ransomware, oraz wdrożenie rozwiązań, takich jak solidna analiza ryzyka i regularne aktualizacje oprogramowania.
Aby doświadczyć bezproblemowego i zgodnego z przepisami procesu zatwierdzania 510(k), skontaktuj się z naszymi ekspertami ds. regulacji. Bądź na bieżąco! Zgodność z przepisami!









