
W ramach realizacji wizji globalnej identyfikowalności urządzeń Ministerstwo Bezpieczeństwa Żywności i Leków Korei Południowej (MFDS) zaproponowało/nakazało wprowadzenie nowego wymogu regulacyjnego dotyczącego włączenia systemu unikalnej identyfikacji urządzeń (UDI) do wyroby medyczne. Rejestracja wyrobów medycznych i UDI to zintegrowane procedury, a UDI jest warunkiem wstępnym wprowadzenia wyroby medyczne rynek koreański. Aby zapewnić bezpieczeństwo pacjentów, MFDS wprowadziło w 2016 r. zintegrowany system informacji o wyrobach medycznych (IMDIS), platformę służącą do regulowania identyfikowalności wyroby medyczne Korei Południowej.
Zgodnie z art. 2 ustawy o wyrobach medycznych określającej przepisy dotyczące identyfikatorów UDI wyrobów medycznych, system UDI obejmuje numery i kody kreskowe umieszczone na pojemnikach i opakowaniach wyroby medyczne znormalizowanego systemu służącego do ich dokładnej i skutecznej identyfikacji oraz zarządzania nimi. MFDS oczekuje od producentów rejestrowania informacji w platformie IMDIS. IMDIS służy do elektronicznego łączenia systemów informacyjnych związanych z wyroby medyczne.

Źródło: Easy Medical Device
UDI składa się z kodu kreskowego nadającego się do odczytu maszynowego, który zawiera:
- Identyfikator urządzenia - kombinacja cyfr lub liter wygenerowana unikalnie dla każdego produktu w UDI.
- Identyfikator wyrobu - kombinacja cyfr lub liter wygenerowana przez jednostkę produkcyjną w UDI. Zawiera numer produkcyjny (partia, numer seryjny), datę produkcji i informacje o wersji produktu
Harmonogram wdrażania wymogów dotyczących identyfikatorów unikalnych wyrobów medycznych (UDI) na opakowaniach wyroby medyczne:
W ramach rewizji ustawy o wyrobach medycznych w 2016 r. wprowadzono IMDIS w celu zrozumienia i systematycznego śledzenia urządzeń. Po pomyślnym wdrożeniu platformy IMDIS, wprowadzanie kodów UDI na opakowaniach odbywało się etapowo, a kod UDI stał się obowiązkowy, jak pokazano na poniższym rysunku.
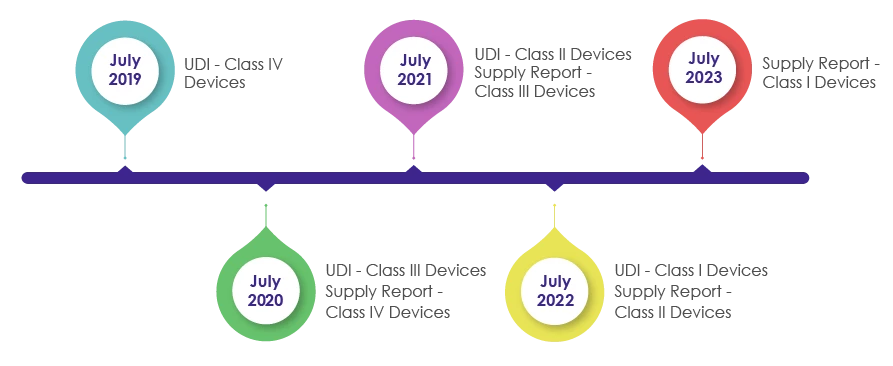
MFDS wymaga od producentów wyrobów medycznych, sprzedawców i dostawców rejestrowania danych dostarczonych urządzeń i dostarczania informacji o dostawie (w tym dostawcy, numeru partii, jednostki opakowania, ilości, daty, ceny jednostkowej według ceny sprzedaży) w raportach dotyczących dostaw w UDI.
Proces generowania kodu UDI:
Producenci lub importerzy wyrobów medycznych nadają swoim wyrobom identyfikator UDI według nazwy modelu i opakowania jednostkowego zgodnie z art. 3 ust. 2 przed wysyłką wyroby medyczne są dopuszczone, certyfikowane lub zgłoszone. W przypadku oznaczenia UDI w postaci kodu kreskowego należy stosować międzynarodowy system standardów GS1. W przypadku UDI-DI należy stosować kod globalnego numeru handlowego (GTIN), natomiast w przypadku UDI-PI należy stosować identyfikatory aplikacji GS1 (AI).
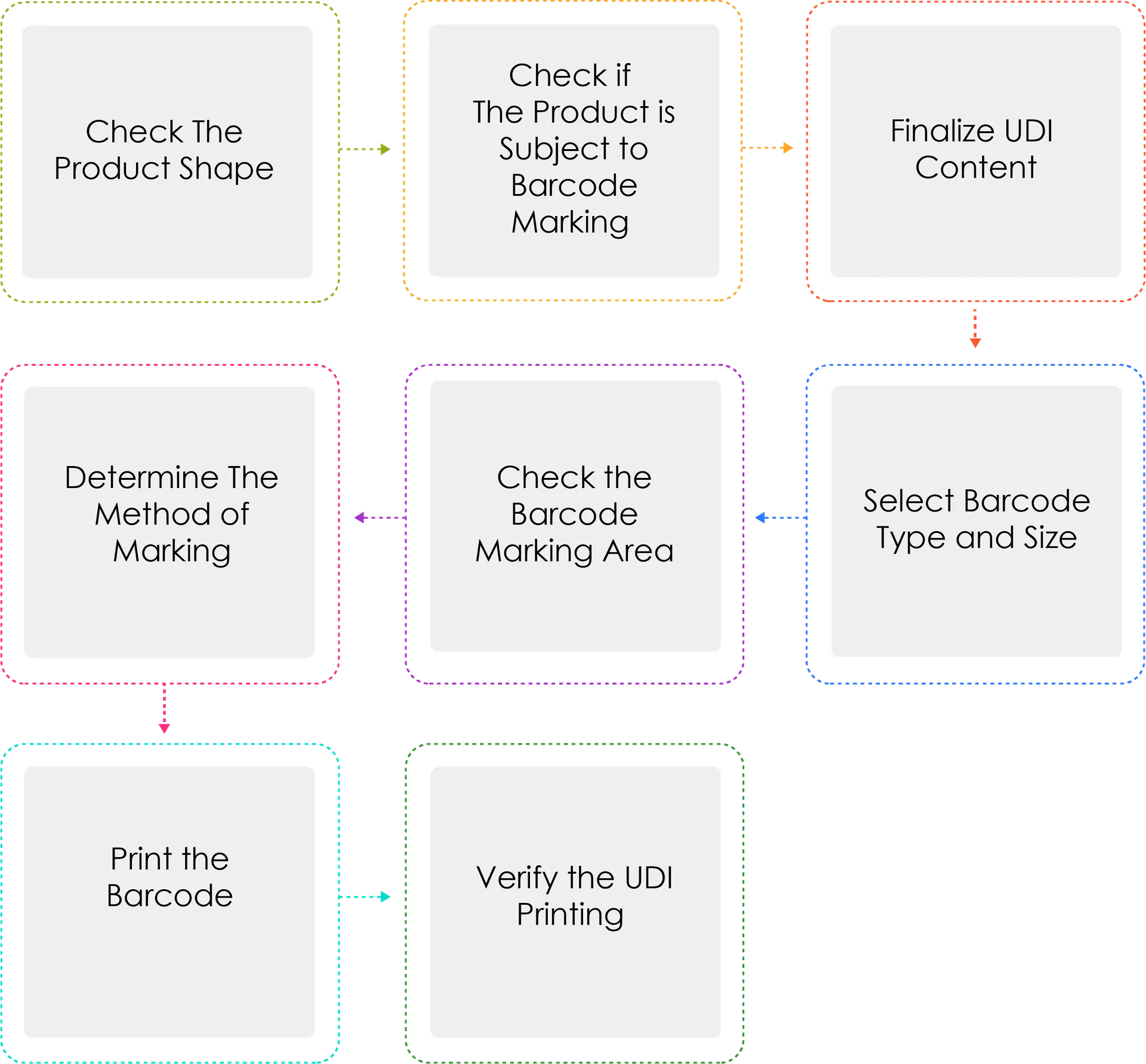
Dlaczego metoda oznaczania Determine jest napisana trzykrotnie?
Dzięki wdrożeniu wymogów zgodności z UDI, MFDS może usprawnić działania przed wprowadzeniem na rynek (tj. zgodność z QMS, ocena badań klinicznych i ogólne zatwierdzenie), a także działania po wprowadzeniu na rynek (tj. raportowanie AE, wycofywanie) urządzeń. Świadome próby śledzenia i monitorowania urządzeń przez MFDS zapewnią bezpieczeństwo i skuteczność urządzeń na rynku Korei Południowej.
Aby dowiedzieć się więcej na temat zgodności z UDI i procesu rejestracji wyrobów medycznych w Korei Południowej, reach z Freyr.









