
Quality Management System (QMS) istotnym elementem branży wyrobów medycznych, zapewniającym bezpieczeństwo, skuteczność i zgodność wyroby medyczne z przepisami wyroby medyczne cykl ich życia. System QMS jest wdrażany na wszystkich etapach cyklu życia wyrobów medycznych, w tym na etapie projektowania i rozwoju, aby zapewnić zgodność wyrobów z przepisami i wymaganiami użytkowników oraz identyfikację i eliminację wszelkich potencjalnych zagrożeń.
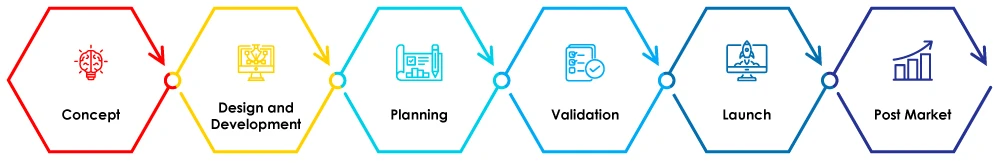
Rysunek 1 - Etapy cyklu życia urządzenia medycznego
Na tym blogu omówimy znaczenie SZJ w fazie projektowania i rozwoju cyklu życia urządzenia medycznego.
Faza projektowania i rozwoju w cyklu życia urządzenia medycznego
Faza projektowania i rozwoju jest jednym z najbardziej krytycznych etapów w cyklu życia urządzenia medycznego. Na tym etapie opracowywany jest projekt urządzenia i tworzone są prototypy, a następnie przeprowadzane są testy weryfikacyjne i walidacyjne w ramach cyklu życia urządzenia medycznego.
Aby zapewnić zgodność wyrobu medycznego z wymogami regulacyjnymi, bezpieczeństwem, skutecznością i oczekiwaniami użytkowników, należy wdrożyć Quality Management System (QMS) na etapie projektowania i rozwoju cyklu życia wyrobu medycznego.
Dokumentacja ma kluczowe znaczenie podczas fazy projektowania i rozwoju wyroby medyczne. System zarządzania jakością zapewnia kontrolę, zarządzanie i dokumentowanie całej dokumentacji związanej z projektowaniem i rozwojem.
Design History File (DHF) ważnym plikiem/rejestrem zawierającym całą dokumentację związaną z projektowaniem i rozwojem urządzenia. Plik DHF stanowi dowód, że projekt urządzenia spełnia wymogi regulacyjne.
DHF powinien zawierać dokumentację związaną z danymi wejściowymi projektu, danymi wyjściowymi projektu, przeglądami projektu, weryfikacją projektu, walidacją, zmianami w projekcie i zarządzaniem ryzykiem. Więcej informacji na temat DHF można znaleźć tutaj.
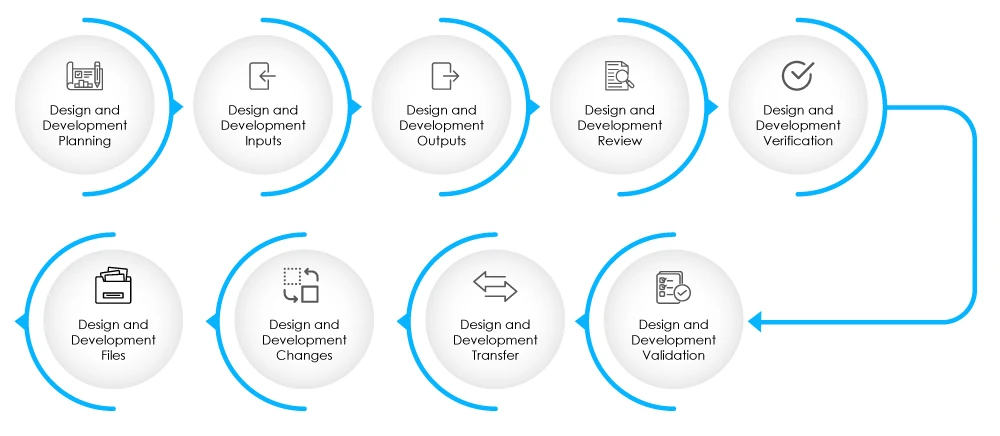
Rys. 2 - Etapy fazy projektowania i rozwoju
Najlepsze praktyki na etapie projektowania i rozwoju
- Ustanowienie ustrukturyzowanego podejścia: Opracuj ustrukturyzowane podejście do rozwoju i zarządzania DHF, które jest dostosowane do konkretnych potrzeb Twojej organizacji. Podejście to powinno obejmować jasne wytyczne, procedury i przepływy pracy dla rozwoju i zarządzania DHF.
- Definiowanie i dokumentowanie danych projektowych: Należy jasno zdefiniować i udokumentować dane wejściowe projektu, w tym wymagania i specyfikacje urządzenia. Może to pomóc w zapewnieniu, że DHF jest kompleksowy i kompletny.
- Zarządzanie zmianami projektowymi: Wdrożenie solidnego procesu zarządzania zmianami, który obejmuje procedury dokumentowania, oceny i zatwierdzania zmian projektowych. Może to pomóc w zapewnieniu, że zmiany są odpowiednio dokumentowane i oceniane pod kątem ich wpływu na bezpieczeństwo i skuteczność urządzenia.
- Zapewnienie identyfikowalności: Należy opracować matrycę identyfikowalności, która łączy dane wejściowe projektu z danymi wyjściowymi projektu i zapewnia, że wszystkie działania projektowe i rozwojowe są odpowiednio udokumentowane i zarejestrowane. Może to pomóc w zapewnieniu, że DHF jest identyfikowalny, a proces decyzyjny jest dobrze udokumentowany.
- Równowaga między innowacyjnością a zgodnością z przepisami: Rozwijanie kultury innowacji przy jednoczesnym zapewnieniu zgodności z wymogami związanymi z DHF, takimi jak kontrola projektu i zarządzanie ryzykiem. Można to osiągnąć poprzez opracowanie procedur i przepływów pracy, które ułatwiają innowacje, zapewniając jednocześnie spełnienie wymogów regulacyjnych.
- Wdrożenie kontroli dokumentów: Wdrożenie procedur kontroli dokumentów, które zapewniają, że dokumenty DHF są odpowiednio kontrolowane, kontrolowane pod względem wersji i dostępne dla upoważnionego personelu. Może to pomóc w zapewnieniu, że dokumenty DHF są bezpieczne, a zmiany są odpowiednio udokumentowane i zatwierdzone.
- Przeszkolenie zespołu: Upewnij się, że zespół odpowiedzialny za rozwój i zarządzanie DHF jest odpowiednio przeszkolony w zakresie wymagań DHF i posiada wiedzę techniczną niezbędną do opracowania produktu. Można to osiągnąć poprzez regularne sesje szkoleniowe, mentoring i zatrudnianie doświadczonych specjalistów z niezbędnymi umiejętnościami i wiedzą.
Postępując zgodnie z tymi najlepszymi praktykami, branża urządzeń medycznych może zapewnić zgodność z wymogami regulacyjnymi, promować bezpieczeństwo i skuteczność swoich produktów oraz utrzymać przewagę konkurencyjną na rynku.
Podsumowując, wdrożenie SZJ od fazy projektowania i rozwoju ma kluczowe znaczenie dla odniesienia sukcesu w wysoce regulowanej branży urządzeń medycznych. Prowadząc systematyczną dokumentację i spełniając wymogi regulacyjne, branża urządzeń medycznych może zapewnić, że dostarcza produkty wysokiej jakości i utrzymuje zadowolenie klientów.
W Freyr oferujemy usługi w zakresie systemów zarządzania jakością (QMS), aby pomóc branży urządzeń medycznych spełnić wymogi regulacyjne na wszystkich etapach cyklu życia urządzeń medycznych.Skontaktuj sięz naszymi ekspertami ds. QMS i regulacji, aby dowiedzieć się więcej.









