
510(k) lub powiadomienie przed wprowadzeniem do obrotu to wniosek składany do Amerykańskiej Agencji ds. Żywności i Leków (US FDA) w celu wykazania, że urządzenie, które ma być wprowadzone do obrotu, jest bezpieczne i skuteczne, to znaczy zasadniczo równoważne z urządzeniem legalnie wprowadzonym do obrotu lub urządzeniem referencyjnym. Poniżej przedstawiono trzy (03) rodzaje wniosków 510(k), które może złożyć producent urządzeń medycznych:
- Tradycyjny
- Skrócony
- Specjalny 510(k)
W tym blogu przeanalizujemy przypadki, w których wniosek kwalifikuje się do drugiego typu, skróconego 510(k), zgodnie zFDA US FDA .
Skrócony formularz 510(k) służy do wykazania istotnej równoważności z uznaną normą, specjalną kontrolą lub wytycznymi przy użyciu deklaracji zgodności (DoC). W skróconej wersji wniosku producenci wykazują istotną równoważność z uznanymi normami w oparciu o wykorzystanie dokumentów zawierających wytyczne lub deklaracji zgodności (DoC) zamiast urządzenia referencyjnego, aby ułatwić przeglądFDA US FDA. Poniżej znajduje się schemat blokowy służący do określenia istotnej równoważności dla skróconego wniosku 510(k).
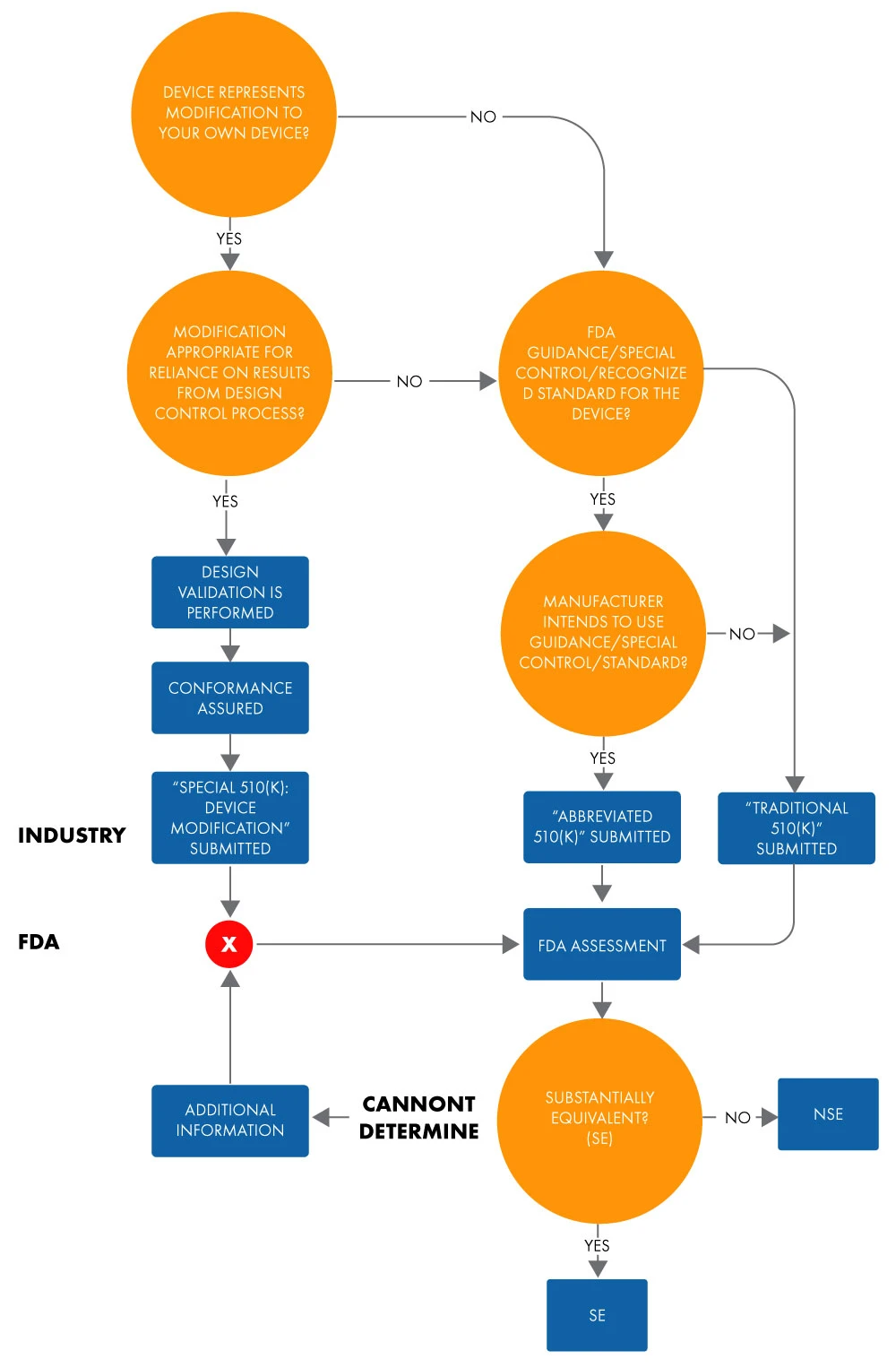
Rysunek 1: Zamiar wprowadzenia urządzenia do obrotu za pośrednictwem 510(k)
Termin "skrócony" sugeruje, że ten typ procesu zatwierdzania 510(k) jest krótszy. Nie jest to jednak do końca prawdą. Zajmuje on tyle samo czasu, co tradycyjne zatwierdzenie 510(k). To samo dotyczy dokumentacji i kosztów. Co więcej, format zarówno tradycyjnego, jak i skróconego 510(k), pod względem podziału na rozdziały i struktury, jest podobny.
Przy składaniu skróconego zgłoszenia 510(k) należy opierać się na elementach określonych w 21 CFR 807.87 (tradycyjne zgłoszenia 510[k]). Możesz zdecydować się na złożenie skróconego 510(k), gdy zgłoszenie opiera się na następujących elementach:
- FDA : Składającskrócony wniosek 510(k), należy dołączyć raport podsumowujący, który przedstawia zgodność z odpowiednimi wytycznymi oraz sposób ich wykorzystania podczas opracowywania i testowania urządzenia.
- Wykazanie zgodności ze specjalnymi kontrolami dla danego typu wyrobu: Należyprzestrzegać specjalnych kontroli, takich jak normy wydajności, Nadzór po wprowadzeniu do obrotu PMS), rejestry pacjentów, opracowywanie i rozpowszechnianie wytycznych, zaleceń itp., które zapewniają rozsądną gwarancję bezpieczeństwa i skuteczności wyrobu. Skrócony wniosek 510(k) oparty na specjalnej kontroli (kontrolach) powinien zawierać następujące elementy. Podsumowanie opisujące zgodność ze specjalnymi kontrolami oraz sposób ich zastosowania podczas opracowywania i testowania urządzenia.
- W jaki sposób specjalne kontrole zostały wykorzystane w celu wyeliminowania określonego ryzyka lub kwestii.
- Informacje opisujące wszelkie odchylenia od określonych kontroli i próby ich przestrzegania przez producenta.
- Dobrowolne standardy konsensusu: Wymagane jest dostarczenie DoC do uznanego standardu dla skróconego zgłoszenia 510(k), które się na nim opiera. DoC powinien zawierać następujące elementy:
- Nazwa i adres wnioskodawcy/sponsora odpowiedzialnego za DoC.
- Szczegóły identyfikacji produktu/urządzenia, w tym kody produktów, nazwa marketingowa urządzenia, numer modelu i wszelkie inne unikalne dane identyfikacyjne produktu specyficzne dla danego DoC.
- Oświadczenie o zgodności.
- Lista standardów, do których ma zastosowanie DoC, w tym opcja(-e) wybrana(-e) dla każdego standardu, jeśli dotyczy.
- NumerFDA US agencjiFDA dla każdego standardu.
- Data i miejsce wydania DoC.
- Podpis, imię i nazwisko oraz funkcja sponsora odpowiedzialnego za DoC.
- Wszelkie ograniczenia dotyczące ważności DoC (na przykład, jak długo deklaracja jest ważna, co było testowane, ustępstwa dotyczące wyników testu itp.
Podsumowując, skrócony 510(k) jest użytecznym sposobem dla producentów urządzeń na wykazanie istotnej równoważności z uznanymi standardami lub specjalnymi kontrolami przy użyciu DoC. Aby zakwalifikować się do skróconego 510(k), producenci urządzeń muszą dostarczyć raport podsumowujący wyjaśniający ich zgodność z odpowiednimi wytycznymi, wykazać zgodność ze specjalnymi kontrolami i dostarczyć DoC do uznanych standardów. Należy jednak zauważyć, że proces zatwierdzania, dokumentacja i koszt skróconej procedury 510(k) są podobne do tradycyjnych procedur 510(k).
Czy Twoje urządzenie medyczne kwalifikuje się do skróconej procedury zgłoszenia 510(k)? Jeśli potrzebujesz pomocy w złożeniu skróconego wniosku 510(k), reach z naszymekspertem ds. regulacji. Bądź na bieżąco! Dbaj o zgodność z przepisami!









