
Asuntos Regulatorios RA) desempeñan un papel fundamental a la hora de garantizar la seguridad, la eficacia y la calidad de los medicamentos en el dinámico panorama farmacéutico. RA la química, la fabricación y los controles (CMC) RA esenciales para el cumplimiento normativo. Su objetivo es proteger la salud de los pacientes y promover la confianza del público en los productos farmacéuticos, garantizando la coherencia y la calidad en todo el proceso de fabricación de los medicamentos.
RA CMC RA los requisitos de documentación y cumplimiento relacionados con la fabricación, el control de calidad y la estabilidad de los productos farmacéuticos. Implica prestar atención a los detalles y cumplir las directrices reglamentarias a lo largo de todo el ciclo de vida del desarrollo de un medicamento. Para obtener más información sobre la importancia deRA CMC RA,consulte a nuestros expertos.
En este blog, profundizaremos en los fundamentos de CMC RA exploraremos su importancia para lograr el cumplimiento normativo y mantener unos estándares de alta calidad.
El papel de CMC el desarrollo de fármacos
CMC comienzan en las primeras fases del proceso de desarrollo de un fármaco y continúan a lo largo de todas las etapas, desde la investigación preclínica hasta la comercialización. CMC y la documentación CMC son componentes fundamentales de las solicitudes reglamentarias, como las solicitudes de nuevos fármacos en investigación (IND), las solicitudes de nuevos fármacos (NDA) y las solicitudes de autorización de comercialización (MAA). Las autoridades reguladoras revisan CMC para evaluar la seguridad, la identidad, la potencia y la calidad de un medicamento, así como la fiabilidad y la coherencia del proceso de fabricación.
Garantizar el cumplimiento de la normativa CMC RA
El cumplimiento de los requisitos CMC es fundamental para una entrada exitosa en el mercado. Las autoridades reguladoras, como la Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA), la Agencia Europea de Medicamentos (EMA) y otras autoridades sanitarias regionales (HA), son responsables de establecer las directrices y normas que deben seguirse. Estas directrices abarcan diversos aspectos, entre ellos las prácticas de fabricación, los sistemas de calidad, los métodos analíticos, las pruebas de estabilidad y la validación. El cumplimiento implica una documentación meticulosa, la adhesión a las buenas prácticas de fabricación (GMP) y la aplicación de sistemas de gestión de la calidad (QMS) eficaces.
El papel del CMC en el éxito de una empresa farmacéutica
Mantener unos altos estándares de CMC ofrece varias ventajas a las empresas farmacéuticas. Algunas de las principales ventajas son:
- Mitigación de los riesgos reglamentarios.
- Apoyar el éxito de las aprobaciones reglamentarias.
- Reducción de la probabilidad de retirada de productos.
- Fomentar una reputación positiva de calidad y fiabilidad.
Puntos a tener en cuenta paraCMC buenCMC RA CMC :
- Mantenerse al día con los conocimientos normativos: La evolución de los requisitos normativos de las autoridades sanitarias exige mantenerse al día con las últimas directrices. El seguimiento continuo de las actualizaciones normativas y su incorporación a CMC es fundamental para mantener el cumplimiento.
- Establecimiento de sistemas de calidad: Esto incluye desarrollar y mantener Standard Operating Procedures (SOPs) completos, procedimientos de control de documentos, procesos de control de cambios y programas de formación para garantizar que los empleados comprendan y sigan los protocolos establecidos.
- Evaluación y mitigación de riesgos: Las empresas deben identificar los riesgos potenciales a lo largo de los procesos de desarrollo y fabricación de medicamentos y aplicar estrategias adecuadas de mitigación de riesgos. Esto incluye la evaluación de los parámetros críticos del proceso, la variabilidad de las materias primas, las impurezas potenciales y los riesgos de la cadena de suministro, que garantizan el cumplimiento.
- Documentación e integridad de los datos: Mantener una documentación precisa y completa es esencial para demostrar la conformidad. Las empresas deben establecer prácticas de documentación sólidas, incluido el mantenimiento de registros de lotes, datos analíticos, estudios de estabilidad e informes de validación. Garantizar la integridad, trazabilidad y seguridad de los datos es fundamental para evitar problemas de conformidad.
- Gestión eficaz del cambio: Las empresas deben contar con procedimientos de control de cambios bien definidos para evaluar y documentar los cambios, evaluar su impacto en la calidad del producto y el cumplimiento de la normativa, y solicitar las aprobaciones necesarias antes de aplicar los cambios.
- Sólidas relaciones con los proveedores y gestión:Esto implica seleccionar proveedores cualificados, realizar auditorías y establecer acuerdos de calidad que describan las responsabilidades y expectativas. Es esencial realizar evaluaciones periódicas del cumplimiento de los requisitos de las buenas prácticas de fabricación actuales (cGMP) por parte de los proveedores.
- Preparación para auditorías e inspecciones: Las empresas deben realizar autoevaluaciones para identificar áreas de mejora y garantizar su preparación para las auditorías reglamentarias. De hecho, abordar con prontitud los resultados de las auditorías y aplicar medidas correctoras es fundamental para mantener el cumplimiento.
- Mejora continua: Esto puede lograrse fomentando el compromiso de los empleados, impartiendo formación y educación sobre los requisitos normativos y promoviendo una mentalidad orientada a la calidad en todos los niveles de la organización.
- Acciones correctivas y preventivas (CAPA): Al abordar sistemáticamente los incumplimientos mediante la metodología CAPA, las empresas farmacéuticas pueden demostrar su compromiso con la mejora continua y el cumplimiento.
- Conocimiento de los cambios reglamentarios posteriores a la homologación: Comprender los requisitos reglamentarios para los cambios posteriores a la aprobación es esencial para garantizar el cumplimiento. La aplicación de procesos adecuados de gestión de cambios y la comunicación eficaz con las autoridades sanitarias pueden ayudar a gestionar estos cambios y garantizar el cumplimiento.
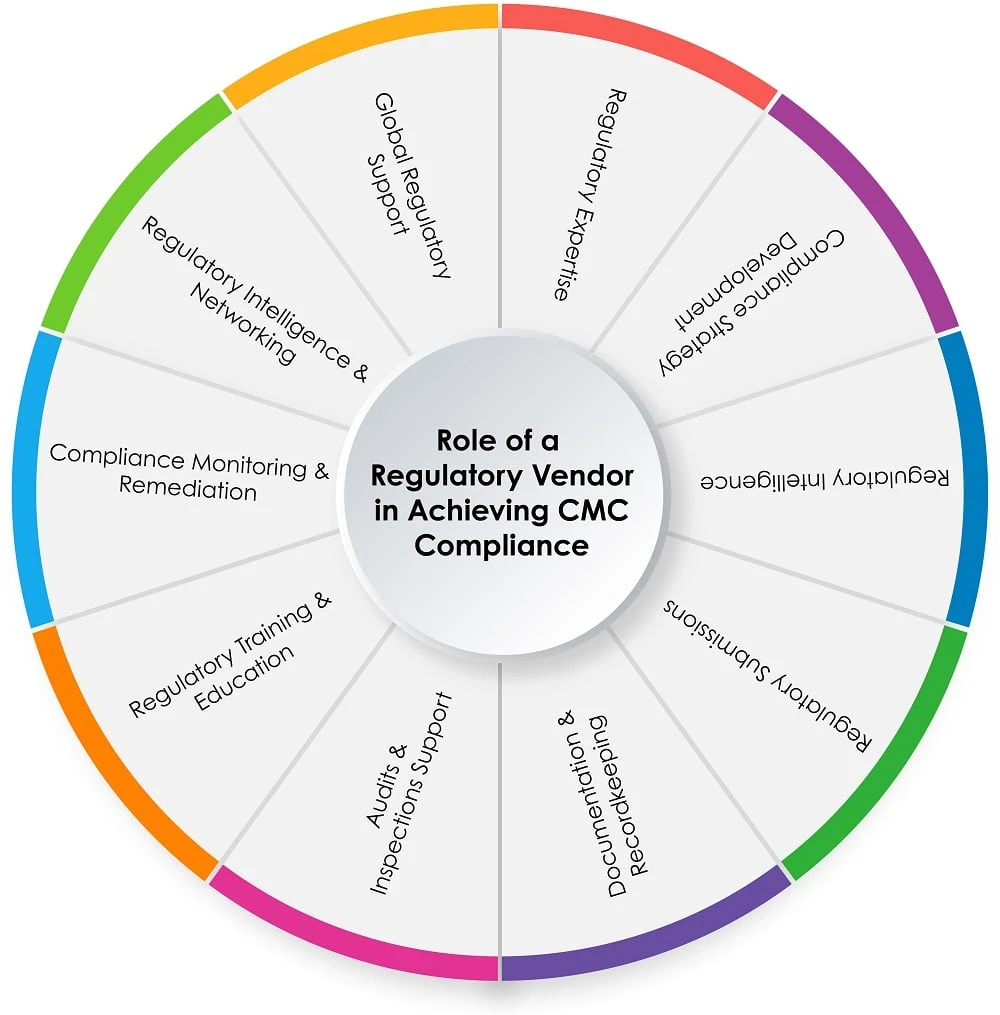
El papel de un proveedor regulador en el proceso CMC
El gráfico circular siguiente (Figura 1) muestra el papel de un proveedor normativo en el proceso CMC :
Figura 1: Función de un proveedor de servicios normativos en el cumplimiento CMC
Conclusión
Lograr y mantener el cumplimiento de CMC exige un enfoque estratégico, que implica la colaboración entre diferentes departamentos, sistemas de calidad sólidos y una inteligencia regulatoria (RI) continua. También es esencial para acceder con éxito al mercado y garantizar la disponibilidad continua de los productos. Un conocimiento profundo de los fundamentos deRA CMC RA la implementación de estrategias de cumplimiento eficaces pueden ayudar a las empresas farmacéuticas a navegar por el panorama normativo, obtener aprobaciones y mantener los más altos estándares de calidad y seguridad de los pacientes.Las asociaciones normativasestratégicas pueden sinergizar estos pasos cruciales al ofrecer la mejor experiencia en su clase para mantener el cumplimiento.¡Póngase en contacto uspara obtener más información sobre nuestros servicios!









