
El 9 de febrero de 2022, la Agencia Europea de Medicamentos (EMA) inició la creación de un Centro de Coordinación para el Análisis de Datos y la Red de Integración del Mundo Real (DARWIN EU®). Se trata del primer paso hacia la integración de la evidencia del mundo real (RWE) en la evaluación de medicamentos en toda la Unión Europea (UE). Garantizar la seguridad y la eficacia de los medicamentos es la actividad principal de cualquier agencia reguladora, y la RWE está demostrando ser una fuente fiable para recopilar datos en tiempo real de bases de datos sanitarias globales. Por lo tanto, esta medida de la EMA por objeto mejorar la calidad de los medicamentos en la región de la UE y acelerar su comercialización.
Principales actividades previstas para el Centro de Coordinación de DARWIN EU®
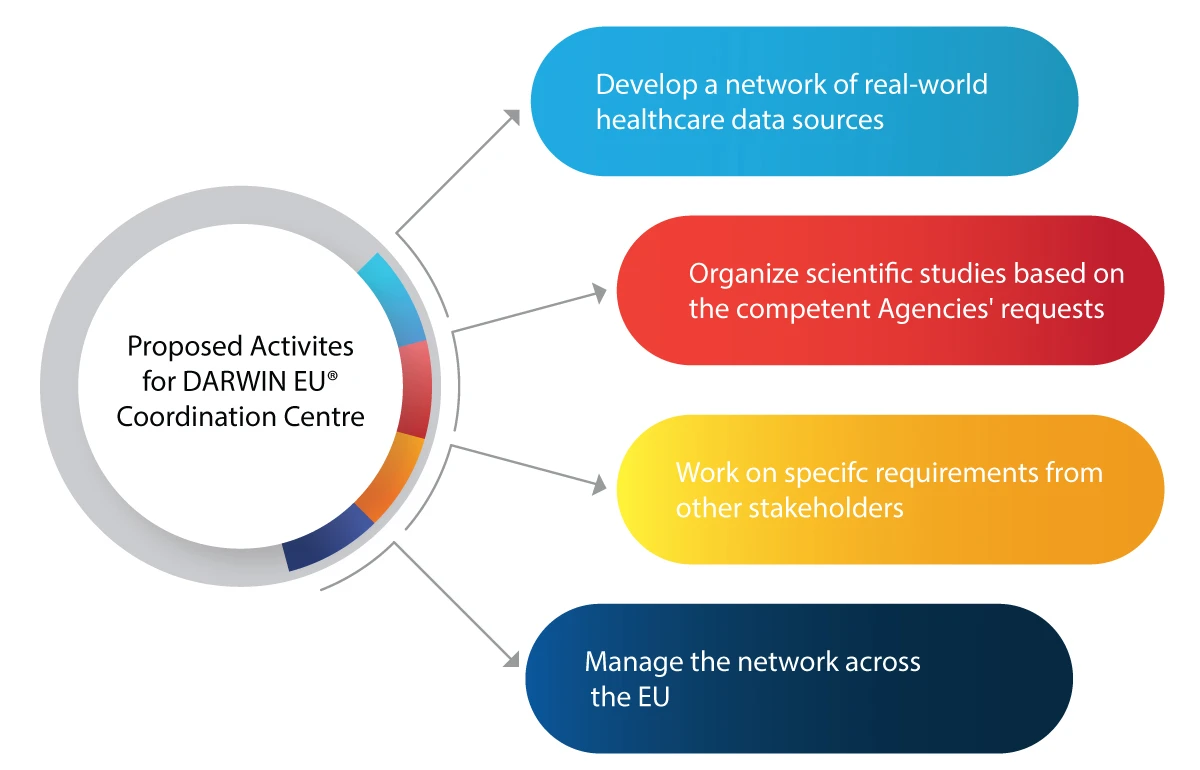
¿Cómo va a ayudar DARWIN EU® a EMA a las autoridades competentes en el ámbito regulatorio?
Los medicamentos innovadores que están fácilmente disponibles para los pacientes son una necesidad imperiosa. Los procesos reglamentarios para el desarrollo, la aprobación, la comercialización y la vigilancia posterior a la comercialización requieren mucho tiempo, lo que hace que la demanda de medicamentos novedosos no se satisfaga. Reducir el tiempo de comercialización y garantizar al mismo tiempo la seguridad, la eficacia y la calidad de los medicamentos innovadores es el camino a seguir. Varias autoridades sanitarias mundiales están identificando las ventajas de integrar los datos del mundo real (RWE) en sus aprobaciones reglamentarias, y DARWIN EU® es la iniciativa EMA.
EMA conectar la Red Europea de Regulación de Medicamentos al Espacio Europeo de Datos Sanitarios (EHDS) para mejorar el intercambio de datos y facilitar el acceso a diversos tipos de datos sanitarios en el marco de este programa. También establecerá normas para las evaluaciones científicas y la toma de decisiones reglamentarias.
Estas son algunas de las actividades que el DARWIN EU® pretende llevar a cabo:
- Utilización de RWE en las actividades de toma de decisiones para la regulación de nuevos medicamentos, vacunas, etc.
- Integración de los datos del mundo real en todo el ciclo de vida de un medicamento, incluyendo su desarrollo, autorización y vigilancia posterior a la comercialización.
- Prepararse para futuras emergencias médicas, como pandemias.
- Beneficiar a la industria farmacéutica con RWE perspicaces y fiables sobre pacientes, enfermedades y uso de medicamentos.
- Tomar decisiones reguladoras informadas basadas en la EMR para el uso seguro y eficaz de los medicamentos.
- Mayor accesibilidad de los medicamentos que salvan vidas a los pacientes que los necesitan gracias a un análisis de datos preciso y oportuno.
Plazos propuestos para que DARWIN EU® sea una red plenamente operativa en la UE
La EMA especifica los plazos para que DARWIN EU® esté plenamente operativo, y son los siguientes:
- 2021 - Inicio del proyecto
- 2022 – Creación de DARWIN EU®
- 2023: desarrollo de DARWIN EU® y definición de sus usos.
- 2024: DARWIN EU® estará totalmente operativo.
- 2025 - Potenciar los usos reglamentarios de los datos sanitarios ampliando los ámbitos en términos de medicamentos, geografía, etc.
La EMA colaborando con el Centro Médico Universitario Erasmus de Róterdam para la creación de DARWIN EU®. El objetivo de esta colaboración es la creación de un centro de coordinación para crear una red de datos distribuida. Ambos se han encargado también de realizar estudios científicos, apoyar los procesos de toma de decisiones reglamentarias y gestionar un catálogo de fuentes de datos del mundo real.
¿Qué significa para el futuro la puesta en marcha de DARWIN EU®?
La EMA la Asociación de Agencias de Medicamentos (HMA) siempre han colaborado para identificar los retos, establecer objetivos con plazos concretos y definir prioridades en sus documentos estratégicos quinquenales. El objetivo es proporcionar una orientación estratégica a las actividades llevadas a cabo por la Red Europea de Agencias de Medicamentos.
La puesta en marcha de DARWIN EU® supone un gran paso hacia la consecución de la estrategia de red EMA. Sus principales objetivos son realizar estudios científicos para responder a cuestiones de investigación, apoyar la evaluación de medicamentos en la UE y mantener metadata las actividades reguladoras de medicamentos. Se prevé que DARWIN EU® sea un actor importante en la regulación de medicamentos en Europa, y se propone que los estudios piloto estén listos para finales de 2022.
Si usted es fabricante de medicamentos y desea obtener más información sobre los datos del mundo real (RWE) y cómo están configurando el futuro de la toma de decisiones reguladoras, póngase en contacto con el Asuntos Regulatorios de Freyr.









