
En Australia, la Administración de Productos Terapéuticos (TGA) aplica normas estrictas para el registro de nuevos medicamentos de venta con receta con principios activos novedosos. Recientemente, la TGA ha presentado un proceso revisado para mejorar la eficacia de los medicamentos con receta que salvan vidas y ponerlos más rápidamente a disposición de los pacientes. Estos cambios afectan a las solicitudes que deben ir respaldadas por datos no clínicos, clínicos y/o de bioequivalencia (categorías 1 y 2). La TGA publicó en agosto un documento con los detalles de los requisitos reglamentarios al respecto.
Características importantes del nuevo proceso de registro de medicamentos sujetos a receta médica
- La TGA ha ideado un proceso de registro por fases y las ha denominado hitos. Cada una de ellas sigue un camino distinto.
- El nuevo proceso pretende mejorar la calidad de los expedientes. Los expedientes se preparan basándose en un formato de documento técnico común (CTD) y siguen todos los requisitos reglamentarios.
- La fase de planificación previa a la presentación es importante, ya que los solicitantes alojan los detalles de la futura solicitud. Esto se hace al menos dos meses y cuarto (02 ¼) antes de la presentación del expediente completo. Esta fase sirve para ayudar a la TGA a fijar las fechas de las etapas posteriores y a preparar los recursos para gestionar el CTD.
- La siguiente fase es la presentación. Una vez hecho esto, la TGA no permite al solicitante ofrecer ningún dato o información adicional después de la fecha de presentación. Es obligatorio presentar un expediente completo, correcto y de calidad.
- En virtud del artículo 31 de la Ley de Productos Terapéuticos de 1989, la TGA solicita información adicional en la fase de evaluación. Tras la evaluación inicial, se cotejan todas las solicitudes y se envían al solicitante.
Para comprender las etapas del proceso de renovación, consulte los siguientes organigramas.
Hito 1
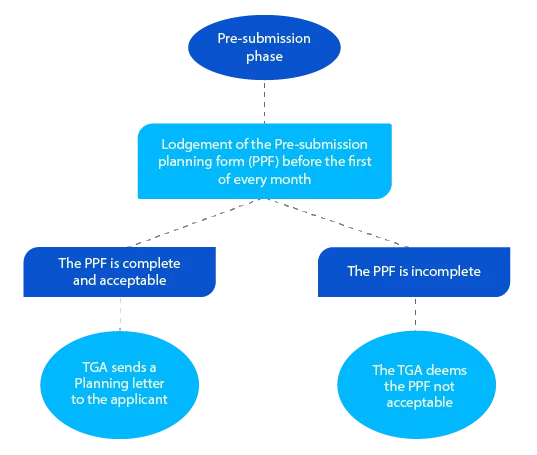
La carta de planificación contiene la fecha prevista en la que la TGA espera la presentación del expediente y otras fechas objetivo para la solicitud del medicamento con receta.
Hito 2
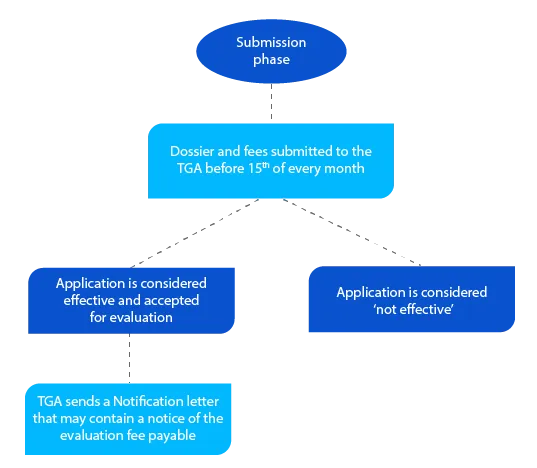
El expediente contiene información que ayuda a la TGA a evaluar la solicitud y, si todo es aceptable, se envía una carta de notificación antes de que finalice el mes en el que el solicitante presentó el expediente.
Hito 3
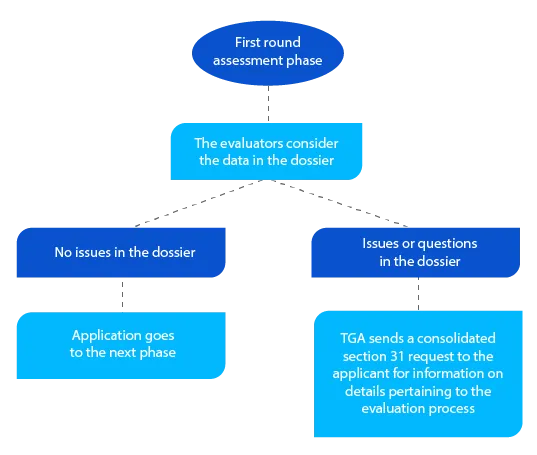
Además de la solicitud consolidada de la sección 31, siempre que proceda, la TGA envía copias de los informes de evaluación elaborados por los evaluadores de calidad, no clínicos, clínicos y de los Planes de Gestión de Riesgos (RMP).
Hito 4

El solicitante puede designar el plazo de respuesta de la sección 31. Puede ser de treinta (30) o sesenta (60) días. Puede ser de treinta (30) o sesenta (60) días y debe resaltarse en el PPF. Este plazo debe ser confirmado por el TGA en la carta de planificación. El formato aceptable de la respuesta es CTD, y la misma debe enviarse en forma de copias impresas y electrónicas.
Dado que se trata de la última oportunidad que tiene el solicitante de facilitar a la TGA la información que le falte, debe hacerlo de manera correcta.
Hito 5
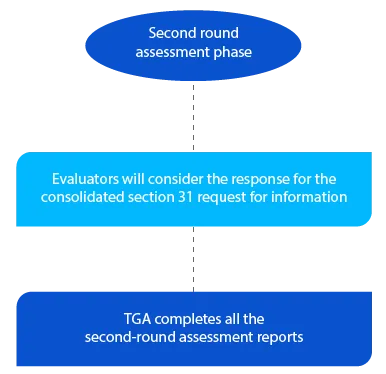
La TGA dispone de dos (02) meses para las solicitudes de nuevos medicamentos genéricos para la segunda ronda de informes de evaluación y de un (01) mes para todos los demás tipos de solicitudes. Los informes se envían a los respectivos solicitantes una vez finalizada la segunda evaluación.
Hito 6
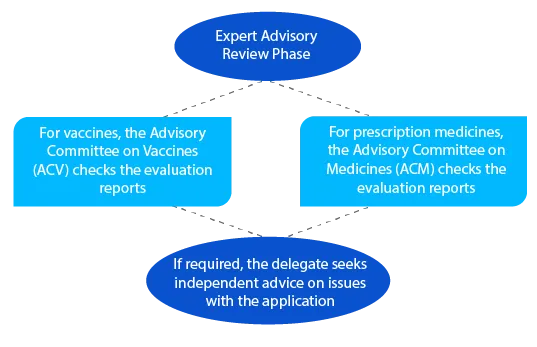
Tras la revisión consultiva, la TGA envía una notificación con los detalles del asesoramiento que recibe del ACV o del ACM.
Hito 7
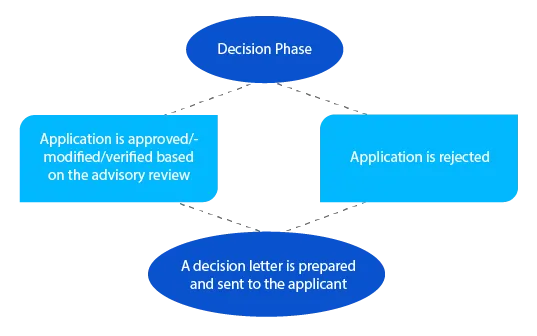
En caso de cuestiones pendientes, el delegado puede ponerse en contacto con el solicitante en esta fase antes de tomar una decisión. En el caso de las solicitudes presentadas en virtud del artículo 23 de la Ley de Productos Terapéuticos de 1989 (medicamentos de nueva evaluación incluidos en el Registro Australiano de Productos Terapéuticos (ARTG)), se enviará una notificación al solicitante en un plazo de veintiocho (28) días a partir de la adopción de la decisión.
Hito 8
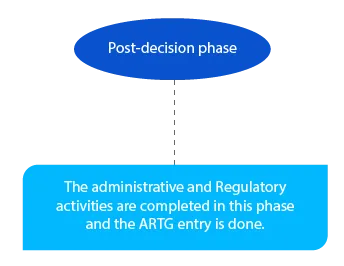
En esta fase se atienden los pagos pendientes. Y debe completarse antes de que finalice el mes siguiente a la decisión del delegado.
Dado que la TGA toma todas las precauciones necesarias para garantizar la seguridad, la eficacia y la calidad de los medicamentos recetados, al tiempo que reduce su tiempo de comercialización, es responsabilidad del solicitante presentar la documentación pertinente para que el proceso de registro se desarrolle sin problemas. Sea cual sea la fase en la que se encuentre, lo ideal es colaborar con un proveedor de servicios end-to-end que sea experto en el registro de medicamentos recetados. Póngase en contacto con una entidad normativa con experiencia para seguir un camino que cumpla con la normativa; manténgase al día y cumpla con la normativa.









