
Las necesidades médicas no cubiertas (UMN) son una de las prioridades más urgentes de los sistemas sanitarios. La constante evolución de la ciencia y la tecnología en el ámbito de la asistencia sanitaria ha abierto la puerta a la posibilidad de explorar diversas opciones terapéuticas. Las autoridades sanitarias fomentan las terapias innovadoras que prometen beneficios significativos para la calidad de vida de los pacientes. Basándose en la priorización de la innovación y centrándose en las necesidades no cubiertas de los pacientes para el desarrollo de medicamentos, la Agencia Europea de Medicamentos (EMA) introdujo en 2016 la vía PRIority MEdicines (PRIME). Desde entonces, la vía PRIME ha sido un método para conceder autorizaciones a terapias innovadoras en un plazo acelerado. Cualquier empresa, desde start-ups hasta medianas empresas biotecnológicas y grandes organizaciones multinacionales, puede explorar este tipo de vía facilitada. Sin embargo, la cualificación para la vía se limita a los productos en fase de desarrollo y que aún no han solicitado una autorización de comercialización mediante el procedimiento centralizado. Los criterios de cualificación se aplican de forma rigurosa. Entre marzo de 2016 y abril de 2022, solo el 24 % de las solicitudes recibieron la aprobación, mientras que el 72 % de las solicitudes PRIME fueron rechazadas. Del 24 % que fue seleccionado para la vía PRIME, la mayoría pertenecía al área terapéutica de la oncología.
Los innovadores que solicitan autorizaciones de comercialización para medicamentos para enfermedades raras o huérfanas suelen disponer de conjuntos de datos limitados como prueba para respaldar sus solicitudes de medicamentos novedosos, tal y como exigen los organismos reguladores. Las solicitudes de medicamentos de terapia avanzada (ATMP) y medicamentos huérfanos suelen enfrentarse a este tipo de retos. Debido a la escasez de datos sobre la población de pacientes, se recomienda una interacción constante con las autoridades reguladoras para obtener una mejor comprensión de los requisitos de revisión científica y aprobación. La vía PRIME puede resultar útil para este tipo de terapias, ya que permite la participación temprana de las autoridades reguladoras, que proporcionan apoyo y orientación proactivos para la recopilación de datos y la evaluación de la relación beneficio-riesgo.
Ventajas de seguir la vía PRIME
- Ayuda a los innovadores a elaborar un plan de desarrollo bien elaborado.
- Beneficia a los innovadores al implicar a las autoridades sanitarias en la fase inicial de desarrollo, lo que contribuye a redactar solicitudes de autorización de comercialización de alta calidad.
- Acelera la evaluación general al reducir el tiempo medio de evaluación, de modo que los medicamentos puedan reach más rápidamente.
- Apoya a los innovadores para que centren su atención en el desarrollo de medicamentos que mejoren los resultados de los pacientes y aborden las necesidades no cubiertas de los mismos.
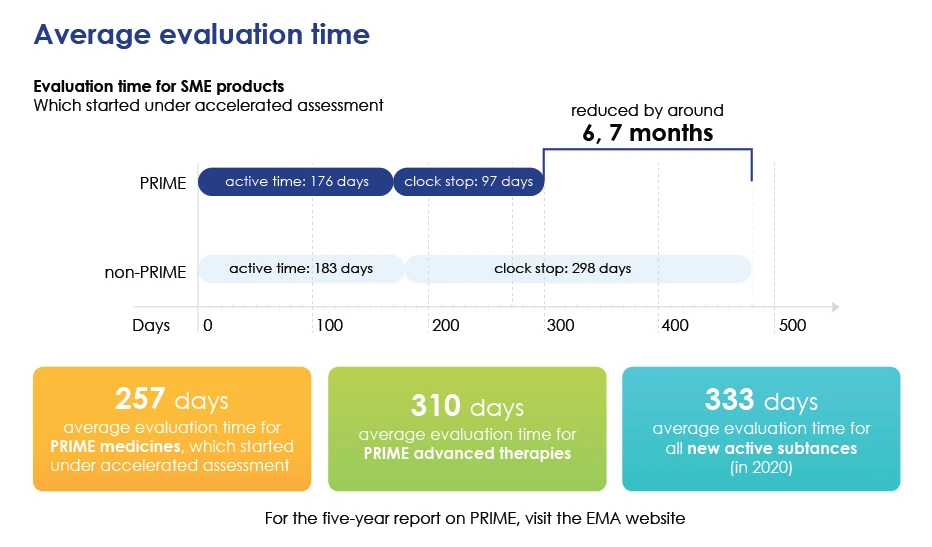
Tiempo de evaluación en detalle
Solicitudes para el itinerario PRIME
La vía PRIME da prioridad a las necesidades médicas no cubiertas. De las 384 solicitudes PRIME recibidas desde marzo de 2016, solo 18 llegaron hasta la autorización de comercialización en junio de 2021.

¿Está preparado para PRIME?
La existencia de la vía PRIME se debe a la existencia de importantes necesidades médicas no cubiertas y al interés de la Red Europea de Regulación de Medicamentos (REGRM) por colmar esas lagunas. Para evaluar la idoneidad de un producto para la vía PRIME, hay que tener en cuenta lo siguiente:
- Conclusiones: Los solicitantes deben exponer la necesidad médica no cubierta y ofrecer un argumento convincente sobre cómo su producto abordará el problema.
- Potencial: Los solicitantes deben demostrar el potencial beneficioso de la terapia en los criterios de necesidad médica insatisfecha.
- Datos preclínicos: Los solicitantes deben presentar algunos datos sobre la eficacia o el rendimiento de la terapia en el sistema biológico humano. Los modelos no clínicos, por muy precisos que sean, no ofrecen una visión exacta de su comportamiento en el sistema biológico humano.
- Fase de desarrollo: El solicitante debe identificar la etapa adecuada para entrar en la vía PRIME para obtener una orientación óptima de los reguladores y seguir adelante con la solicitud.
Contabilizar la subvención PRIME
Una vez que se haya concedido al solicitante la oportunidad de acceder a la vía facilitada, la EMA :
- Designar a un ponente del Comité de Medicamentos de Uso Humano (CHMP) o del Comité de Terapias Avanzadas (CAT) en el caso de las terapias avanzadas.
- Organizar una reunión inicial con el ponente del CHMP/CAT y un grupo multidisciplinar de expertos para orientar sobre el plan general de desarrollo y la estrategia de regulación.
- Asigne un único punto de contacto para el solicitante.
- Proporcionar asesoramiento científico en cada hito clave del desarrollo, con la participación de un conjunto adicional de partes interesadas, como los organismos de evaluación de tecnologías sanitarias, para acelerar el acceso de los pacientes al nuevo medicamento.
- Confirmar el potencial de evaluación acelerada en el momento de una solicitud mientras se considera la autorización de comercialización.
¿Está lista su solicitud para la vía PRIority MEdicine (PRIME)? Póngase en contacto con Freyr hoy mismo y evalúela. Obtenga más información sobre cómo podemos ayudarle con su estrategia regulatoria y la designación de la vía PRIME. Manténgase informado. Mantenga el cumplimiento.









