
Las innovaciones en las combinaciones de fármacos y dispositivos han dado lugar a avances significativos en la atención al paciente. Los medicamentos combinados con dispositivos médicos permiten administrar fármacos de forma selectiva, mejorar los resultados terapéuticos y aumentar la adherencia de los pacientes. Sin embargo, navegar por el panorama normativo de las combinaciones fármaco-dispositivo puede resultar complejo.
Este blog explorará las consideraciones y los retos asociados a las operaciones reguladoras de los productos combinados fármaco-dispositivo, que ofrecen ideas para racionalizar los procesos.
Panorama general y marco regulador de las combinaciones de fármacos y dispositivos
Los productos combinados fármaco-dispositivo combinan los efectos terapéuticos de los medicamentos con la capacidad de administración de los dispositivos médicos. Las combinaciones fármaco-dispositivo incluyen stents liberadores de fármacos, inhaladores y dispositivos respiratorios, parches transdérmicos, sistemas de administración de insulina, sistemas de infusión de fármacos y balones recubiertos de fármacos. La administración selectiva, la mayor eficacia, la mejora de la adherencia del paciente y el control preciso del tratamiento son algunos de los atributos notables de estos productos.
Las autoridades reguladoras, como la Administración de Alimentos y MedicamentosUS EstadosUS FDA), la Agencia Europea de Medicamentos (EMA) y otras, han establecido directrices sobre las combinaciones de medicamentos y dispositivos. En los últimos años se han producido avances notables en el panorama regulador, con un mayor énfasis en la armonización, las evaluaciones basadas en el riesgo y la vigilancia posterior a la comercialización.
Consideraciones clave para las operaciones reguladoras
A continuación se detallan algunas de las consideraciones que deben tenerse en cuenta a la hora de llevar a cabo las operaciones reguladoras de las combinaciones fármaco-dispositivo:
Comprender la clasificación de los productos y las vías de reglamentación
Es fundamental comprender la clasificación de los productos combinados de medicamentos y dispositivos y seleccionar la vía reglamentaria adecuada. Los fabricantes deben determinar si se trata de una combinación de medicamentos y dispositivos, de un dispositivo recubierto de medicamentos o de un producto co. La selección de la vía correcta para el tipo de producto específico es fundamental para acceder con éxito al mercado.
Cumplir los requisitos científicos y técnicos
Incluye garantizar la compatibilidad entre el fármaco y los componentes del dispositivo, realizar estudios de estabilidad para evaluar la vida útil del producto, validar los procesos de fabricación y aplicar evaluaciones de riesgos para identificar y mitigar posibles peligros.
Atención al paciente y pruebas de usabilidad
La atención al paciente y la ingeniería de usabilidad desempeñan un papel importante en el desarrollo de estos productos combinados. Tener en cuenta factores como la interfaz de usuario, la ergonomía, el manejo del dispositivo y la adherencia del paciente durante el desarrollo del producto ayuda a garantizar su uso seguro y eficaz por parte de pacientes y profesionales sanitarios con un mínimo de errores.
Consideraciones posteriores a la comercialización
Las obligaciones posteriores a la comercialización son un aspecto fundamental del cumplimiento normativo para las combinaciones de medicamentos y dispositivos. Los fabricantes deben establecer procesos para la notificación de acontecimientos adversos, la vigilancia posterior a la comercialización y la notificación de casos sospechosos con el fin de supervisar la seguridad y el rendimiento de sus productos.
Mantenerse al día de las últimas directrices y actualizaciones normativas
Mantenerse al día de las últimas directrices y actualizaciones es fundamental para garantizar el cumplimiento normativo y alinear las estrategias reguladoras con las expectativas actuales. El panorama normativo para las combinaciones de medicamentos y dispositivos está en constante evolución. Alinearse con las directrices FDA, Dispositivos Médicos (MDR) de la UE y el Consejo Internacional para la Armonización de los Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH) puede ayudar a los fabricantes a mantener el cumplimiento normativo.
Buenas prácticas para agilizar las operaciones reguladoras
Para optimizar las operaciones reguladoras de las combinaciones fármaco-dispositivo, las empresas farmacéuticas pueden seguir las mejores prácticas ilustradas en el siguiente gráfico circular:
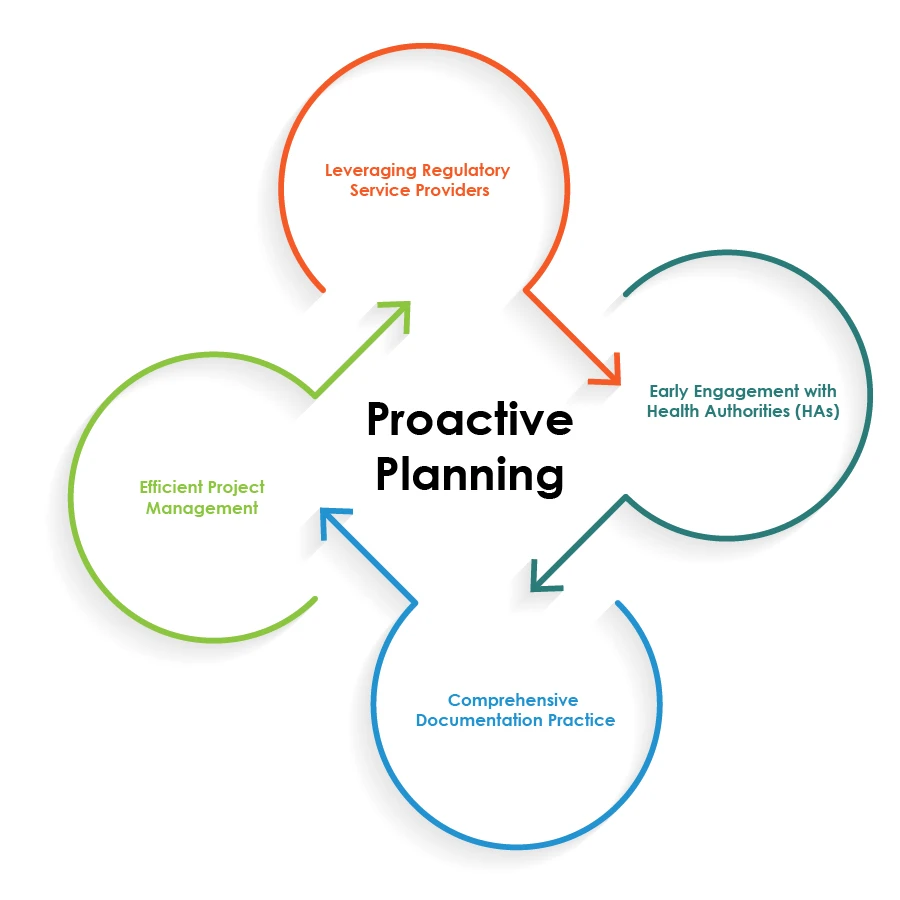
La planificación proactiva es la piedra angular de una combinación perfecta de fármaco y dispositivo Operaciones reglamentarias
Tendencias y retos futuros
Estar atento a las tendencias y deficiencias futuras es crucial para las empresas farmacéuticas y los profesionales de la reglamentación que participan en las operaciones de reglamentación de estos productos. A continuación se enumeran algunas tendencias y retos a tener en cuenta:
- Tecnologías emergentes: La nanotecnología, la impresión en 3D y las aplicaciones afines influyen en el desarrollo de combinaciones innovadoras de fármacos y dispositivos. Estas tendencias tecnológicas permiten la administración selectiva de fármacos, la medicina personalizada y un mejor seguimiento del paciente. Sin embargo, también plantean retos normativos únicos relacionados con la seguridad, la eficacia y el control de calidad.
- Ciberseguridad: Con la creciente conectividad de los dispositivos médicos, garantizar la seguridad de los datos y la protección contra las amenazas cibernéticas se convierte en primordial. Integrar medidas sólidas de ciberseguridad y mantenerse al día de las mejores prácticas de seguridad de los dispositivos son consideraciones fundamentales para las operaciones de Reglamentación.
- Retos varios: Entre ellos se incluyen las complejidades de la cadena de suministro global, como el abastecimiento de materias primas, la disponibilidad de componentes y los procesos de fabricación, que plantean retos a la hora de mantener el cumplimiento de la normativa y garantizar la calidad del producto. Para afrontar estos retos y mitigar los riesgos asociados, son esenciales unas prácticas sólidas de gestión de la cadena de suministro, la evaluación de riesgos y la supervisión de los proveedores.
Navegar por el panorama normativo de los productos combinados de medicamentos y dispositivos requiere un conocimiento exhaustivo del marco normativo, las directrices recientes y las mejores prácticas. Abordar las consideraciones clave, mantenerse al día de los cambios e implementar las mejores prácticas ayudará a las empresas farmacéuticas a optimizar sus operaciones normativas. La colaboración con proveedores normativos permite a las empresas aprovechar los conocimientos y la experiencia especializados y optimizar sus posibilidades de éxito normativo en este campo tan exigente y en constante evolución. Con nuestra probada experiencia en el cumplimiento de las normas normativas globales, Freyr puede ayudar a lograr un proceso de producto conforme. Para obtener más información, póngase en contacto us.









