
Para mejorar la accesibilidad de los medicamentos innovadores para los pacientes del Reino Unido tras el Brexit, en enero de 2021 se puso en marcha una nueva vía de aprobación acelerada conocida como Innovative Licensing and Access Pathway (ILAP). Su objetivo principal era proporcionar una hoja de ruta integrada para todas las partes interesadas que mejorara el proceso de desarrollo de productos. La ILAP apoya además a los desarrolladores comerciales y no comerciales al facilitar el acceso de los pacientes a los medicamentos innovadores, reduciendo el tiempo de comercialización. Las empresas farmacéuticas pueden explorar la ILAP como vía una vez que se hayan consolidado los datos no clínicos. Es aplicable a nuevas entidades químicas (NCE), medicamentos biológicos, nuevas indicaciones y medicamentos reutilizados.
El ILAP es una iniciativa desarrollada conjuntamente por la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) en asociación con el Centro Terapéutico y Toxicológico de Gales (AWTTC), el Instituto Nacional de Salud y Excelencia Clínica (NICE) y el Consorcio Escocés de Medicamentos (SMC) como socios permanentes. Entre los socios que apoyan al ILAP se encuentran el Servicio Nacional de Salud de Inglaterra (NHS), la Autoridad de Investigación Sanitaria (HRA) y el Instituto Nacional de Investigación Sanitaria (NIHR). Juntos, los interesados aportan mejores contribuciones normativas, científicas, éticas y comerciales en la fase inicial del desarrollo de los medicamentos durante los ensayos clínicos.
En opinión Freyr, el ILAP ofrece grandes oportunidades a los desarrolladores de tratamientos innovadores, especialmente a aquellos que abordan las necesidades no cubiertas de los pacientes. Por una tarifa relativamente modesta (aproximadamente 8000 £), una empresa puede obtener asesoramiento en una fase temprana, conseguir una designación para su producto y acordar un perfil de desarrollo objetivo. Esto puede suponer un ahorro de tiempo significativo en el ciclo de vida global del desarrollo del producto. También es beneficioso mirar más allá de la autorización de comercialización y prepararse con antelación para las negociaciones sobre el reembolso.
El ILAP se compara favorablemente con programas similares ofrecidos dentro de la red europea de medicamentos (como el PRIME). Aunque difiere en cuanto a concepto y ejecución, el ILAP tiene criterios de aceptación más amplios y una tasa de aceptación más alta. El ILAP también ofrece una vía para la integración con el Proyecto Orbis de la Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA) para productos oncológicos emergentes.
¿Cómo solicitar el ILAP?
Para acceder al ILAP, los solicitantes deben solicitar un Pasaporte de Innovación (IP). La obtención de la designación IP permite a los desarrolladores de medicamentos acceder a la vía basada en las pruebas necesarias para que un producto cumpla los criterios de elegibilidad definidos por el NICE, el SMC, el AWTTC y la MHRA.
Esta designación actúa como catalizador de productos innovadores desde la fase preclínica hasta la fase intermedia de desarrollo. La propiedad intelectual puede conducir a la definición de un documento de perfil de desarrollo de objetivos (Target Development Profile, TDP). El TDP es una hoja de ruta que facilita el acceso a los socios del ILAP en las primeras fases del ciclo de vida del desarrollo de fármacos para acelerar y agilizar el acceso de los pacientes a tratamientos nuevos e innovadores. Los pacientes forman parte de todo este proceso. Varias herramientas proporcionadas por el ILAP apoyan a los solicitantes en todas las etapas del proceso de diseño, desarrollo y aprobación.
Criterios de designación de pasaportes innovadores
MHRA aclara los criterios para la designación de propiedad intelectual. Esto es especialmente relevante para los productos innovadores y también se compara favorablemente con los programas equivalentes que se ofrecen en Europa.
En el futuro, la aplicabilidad específica de la propiedad intelectual a los dispositivos médicos y los productos combinados, ámbitos en los que siempre se producen importantes innovaciones, puede resultar beneficiosa.
La designación de PI es evaluada por los socios permanentes y de apoyo basándose en los siguientes criterios:
- Criterio 1: Detalles de la afección, el paciente o el área de salud pública
- Para enfermedades graves y potencialmente mortales
- En un caso en que la necesidad es crucial para los pacientes
- Criterio 2: El medicamento cumple uno o más criterios específicos que incluyen
- Medicina innovadora
- Medicamento asociado a una nueva indicación
- Medicamentos para enfermedades raras
- Medicamentos en desarrollo para el objetivo de la sanidad pública británica
- Criterio 3: El medicamento tiene potencial para ofrecer
- Un resumen de cómo beneficiará a los pacientes el medicamento o la indicación propuestos.
- Se anima a los pacientes o a las organizaciones de pacientes a dar su opinión.
Al presentar la solicitud de propiedad intelectual, MHRA celebra una reunión entre los solicitantes y la MHRA para determinar si el producto cumple los tres (03) criterios.
Según la información más reciente de enero de 2022, la MHRA recibido setenta y una (71) solicitudes, de las cuales cuarenta y una (41) han obtenido la designación IP, veintidós (22) están en trámite y siete (7) han sido rechazadas.
A continuación se menciona el momento adecuado para entrar en la ILAP.
- En la fase inicial o media de desarrollo del producto
- Cuando se disponga de datos pertinentes
- Cuando los solicitantes sientan la necesidad de obtener aportaciones de las partes interesadas
- Los candidatos aspiran a adoptar nuevos enfoques innovadores
- No cuando el producto está hacia el final de la fase de desarrollo.
Visión general del desarrollo de medicamentos
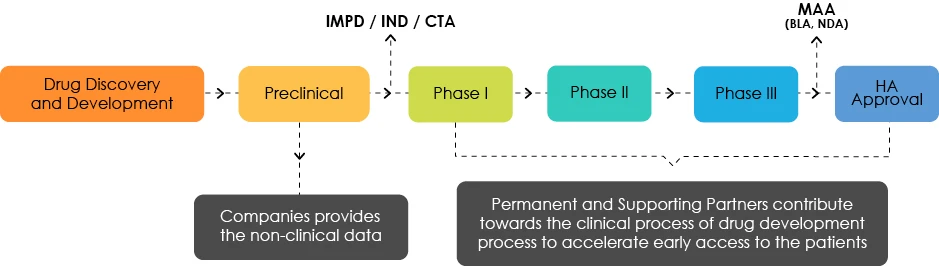
Entender el Perfil de Desarrollo de Objetivos (PDO)
Los expertos del PDT analizan las características del producto y ponen de relieve las deficiencias desde el punto de vista normativo. Se encargan de orientar a los desarrolladores de fármacos hacia una hoja de ruta que permita el acceso temprano de los pacientes a sus productos.
El PDT es un documento que se actualiza en tiempo real en función de los requisitos relacionados con el desarrollo del producto. Por lo tanto, un producto se somete a múltiples modificaciones del PDT a medida que se generan nuevos datos.
El acceso de los pacientes a los medicamentos esenciales puede verse comprometido por los retrasos del mercado. Para evitar estas situaciones, las vías aceleradas funcionan como catalizadores. El ILAP es un ejemplo de vía de autorización flexible que goza de una buena aceptación en todo el sector y puede acelerar el calendario de desarrollo de medicamentos innovadores. Los criterios detallados definidos por el sistema sanitario del Reino Unido permiten a los solicitantes explorar su elegibilidad para solicitar la designación de propiedad intelectual. Incentivar las necesidades clínicas y de los pacientes no satisfechas con vías aceleradas como el ILAP facilita la entrada en el mercado y puede proporcionar alivio a las poblaciones de pacientes en riesgo. Para salvaguardar los intereses de los pacientes, las autoridades sanitarias no comprometen la seguridad, la eficacia o la calidad del producto, al tiempo que garantizan un proceso de aprobación acelerado.Los servicios regulatorios end-to-end de Freyr facilitan el proceso de documentación para respaldar la designación de pasaporte innovador en un plazo acelerado, lo que ayuda a que sus productos reach antes reach . Póngase en contacto con Freyr.









