
CUMPLIMIENTO IDMP NORMATIVA IDMP EN JULIO DE 2016: UNA TARE
Hay muchas preguntas sobre IDMP ejemplo: ¿dónde se encuentran los datos en una organización? ¿Es necesario limpiar y alinear los datos actuales? ¿Cómo organizan las empresas estos datos para facilitar su recuperación y presentación? ¿Dispone la organización de procesos que puedan beneficiarse de un repositorio central?
Lograr el cumplimiento de la Identificación de Medicamentos (IDMP) no es una tarea trivial, ya que la actividad debe tener en cuenta diversas presiones normativas y operativas. Las organizaciones deben esperar hasta que las autoridades publiquen las directrices definitivas y aprueben las especificaciones. Al mismo tiempo, esperar estas directrices podría no dejarles tiempo suficiente para poner sus asuntos en orden.
IDMP una norma compleja con implicaciones generales en materia de datos que requiere la colaboración y co entre muchas unidades interfuncionales. La transición brinda la oportunidad de end-to-end los procesos empresariales y las capacidades informáticas de una organización en muchas unidades funcionales. También ayuda a establecer un sistema sólido de gestión del cambio.
Las organizaciones deben comprender que una buena arquitectura de la información requiere esfuerzo y tiempo para llevarse a cabo, y también deben reconocer que IDMP no IDMP solo un XEVMPD más grande. También es importante señalar que ICH son solo una parte del panorama, y que la disponibilidad de directrices regionales es fundamental. También hay que tener en cuenta que las implementaciones regionales paralelas tendrán diferentes alcances y plazos, con una amplia variedad de contribuyentes de datos.
Además, las empresas farmacéuticas que deseen comercializar sus productos en regiones reguladas deben IDMP a partir de 2016. Recientemente, EMA una jornada IDMP IDMP y compartió su estado de implementación IDMP nivel y sus plazos. Tras debatir con la industria farmacéutica y los proveedores de software, y analizar su propio sistema y la disponibilidad de recursos, EMA planeado dividir laIDMP globalIDMP en varias iteraciones. Este plan se propondrá a European Commission CE) para su aprobación y, si logran convencer a la CE, IDMP en la UE se extenderá entre 2016 y 2018. En el peor de los casos, si la CE no está de acuerdo, no hay un plan B. Las multas por incumplimiento ascienden hasta el 5 % de los ingresos de una organización; no contar con una buena solución para IDMP inicial y continuo IDMP es un riesgo que ninguna empresa farmacéutica puede permitirse correr.
IDMP: DESARROLLADO COMO UN CONJUNTO GLOBAL DE NORMAS BAJO LA NORMA ISO
En caso de que se deba introducir alguna legislación sobre la identificación de medicamentos en cualquiera de los países ISO, se hará basándose en IDMP de la ISO. Una vez que las diferentes regiones adopten las IDMP , la introducción de datos será coherente y, a su vez, las empresas y los organismos reguladores globales tendrán acceso a datos cruzados para comprobar la coherencia entre las regiones. Además, los vocabularios controlados comunes facilitarán en gran medida este proceso.
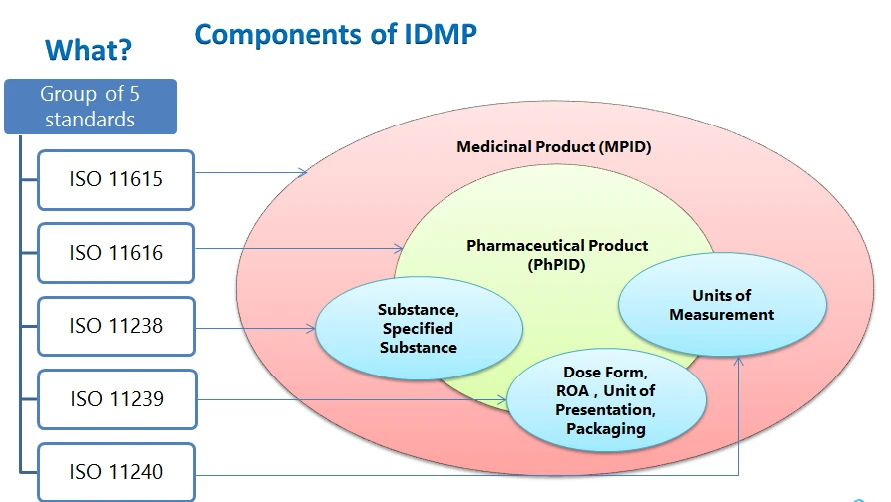
Los elementos estructurales del IDMP la identificación del medicamento, la identificación del producto farmacéutico, la identificación de la sustancia, los vocabularios controlados (forma farmacéutica, vía de administración, componentes del envase, unidades de presentación, unidades de medida) y la descripción del proceso de fabricación que se debe presentar.
IDMP
- ISO 11615 - Información sobre medicamentos
- ISO 11616 - Información sobre productos farmacéuticos
- ISO 11238 - Sustancias
- ISO 11239 - Formas farmacéuticas dosificadas, Unidades de presentación, Vías de administración y Envasado
- ISO 11240 - Unidades de medida
ESTADO ACTUAL
ICH preparando guías de implementación y revisando las normas ISO.
LOS REGULADORES DE LA UE SE PREPARAN PARA IDMP
- EMA iniciado los trabajos para colaborar con la red reguladora de la UE con el fin de definir los casos de negocio para los IDMP .
- EMA creando un «IDMP ISO IDMP de la UE reclutar expertos de EMA y de la Junta de Datos de la Red de la UE para lograrlo. En concreto, se encargará de:
- Definir los elementos IDMP obligatorios y opcionales del ISO IDMP .
- Definir reglas de negocio para elementos de datos opcionales
- Definir la conformidad y los tipos de datos
- Definir los modelos de gobernanza de la UE
POSICIÓN US
- Liderazgo activo en IDMP con los organismos reguladores mundiales (antes ICH) y con la ISO.
OTROS REGULADORES
- Suiza - Pretende implantarse después de la UE (fast follower)
- Japón y Canadá han designado a los reguladores que formarán parte del Grupo de Expertos en Sustancias Inflamables.
CRONOLOGÍA
GUÍAS EUROPEAS DE APLICACIÓN
- Se inicia el borrador de las guías de aplicación, que estarán disponibles a partir del primer trimestre de 2016
OTROS
- FDA aún FDA una fecha, pero tiene la intención de desarrollar el SPL según sea necesario.
- Japón: incertidumbre en ICH ahora trabajando dentro del grupo regulador y la ISO.
- Canadá - Se prevé su aplicación, pero aún no hay datos concretos.
- Suiza - Aún no hay actualizaciones
COMPRENSIÓN DE LOS REQUISITOS DE IDMP
IDMP información sobre los medicamentos en términos de un conjunto de identificadores estándar, que se basan en una jerarquía de identificación creada durante la elaboración del Diccionario de Medicamentos de EudraVigilance (EVMPD) o en su forma ampliada (xEVMPD). Habrá un solapamiento de información con la archivada en Structured Product Labeling (SPL) en los US otros registros de productos a nivel mundial.
Sin embargo, IDMP nuevos identificadores, nuevas categorías y nuevas formas de expresar las relaciones entre los elementos del modelo de datos. IDMP integrarse en el ADN de la organización, ya que debe impulsar la construcción de modelos de datos en toda la empresa. De este modo, la infraestructura informática de una organización puede reconocerlo en múltiples sistemas, procesos empresariales y unidades funcionales, como RA, Seguridad, I+D, documentación y procesos de fabricación.
DESAFÍOS IDMP
Organización
- Datos distribuidos entre varios departamentos
- Se requiere el patrocinio de personas mayores para fomentar la participación
Técnico
- Descubrir, recopilar y consolidar datos limpios
- De 250 a 300 campos por producto
Co
- Gestión del cambio continuo
- Co entre múltiples equipos
- Mantener la regulación de datos con procesos internos
EN CONCLUSIÓN:
IDMP: IMPACTO EN LA INDUSTRIA FARMACÉUTICA
Se espera que la implementación de IDMP tenga un impacto en la preparación y planificación de las presentaciones y el mantenimiento de los datos de toda la empresa, incluidos los datos de fabricación y la información estructurada sobre las sustancias para el registro.
IDMP : AUMENTO DE LA EFICIENCIA GARANTIZADO TRAS SU IMPLEMENTACIÓN
Para garantizar que su organización esté preparada para afrontar el IDMP , será necesaria una estrecha colaboración entre varios departamentos de la misma. Un proveedor de servicios competente, con una cartera exclusiva de competencias normativas, puede ayudar a avanzar hacia IDMP , lo que a su vez puede ayudar a la organización a responder a las nuevas oportunidades que surgen en el mercado.









