
La necesidad de medicamentos que salvan vidas está en constante aumento. Debido a la aparición de nuevas enfermedades mortales, los fabricantes de medicamentos están dedicando mucho tiempo y dinero a la investigación y el desarrollo de medicamentos químicos y biológicos. Tan difícil como inventar medicamentos innovadores puede resultar para los fabricantes registrarlos. Desde la preparación y presentación de la solicitud de nuevo fármaco en investigación (IND) hasta las solicitudes de ensayos clínicos (CTA) y las autorizaciones de comercialización (MA), hay una serie de procedimientos reglamentarios que deben seguirse, según lo prescrito por las respectivas autoridades sanitarias (HA).
Los fabricantes deben hacerlo bien a la primera para que los medicamentos innovadores reach mercado sin retrasos. Esto ayudará a satisfacer la demanda de medicamentos que salvan vidas en mercados específicos y garantizará el retorno de la inversión (ROI) para los fabricantes.
Por tanto, la necesidad de soluciones normativas mejoradas y procesos conformes es bastante crucial. Hay varias razones por las que los fabricantes no pueden seguir el camino adecuado.
Desafíos normativos a los que se enfrentan los fabricantes de medicamentos innovadores
- Falta de comprensión de las complejidades reglamentarias
- Conocimiento limitado de las distintas fases de presentación de solicitudes a las autoridades sanitarias.
- Plazos para la presentación de los expedientes médicos, el Documento Técnico Común (CTD), los Informes de Estudios Clínicos (CSR), etc.
- Diferencias en la normativa cuando los medicamentos se van a vender en todo el mundo
- Falta de preparación para hacer frente a cualquier problema o dificultad que surja en la fase de fabricación.
Ventajas de colaborar con el proveedor de soluciones/servicios normativos adecuado:
El socio adecuado garantizará que todas las etapas de la fabricación de medicamentos cumplan las normas de los organismos reguladores pertinentes y se presenten a tiempo.
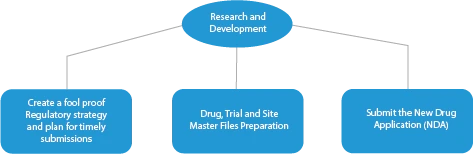
Existen cuatro (04) etapas en la fabricación de un medicamento innovador. Son las siguientes:
- Investigación y desarrollo
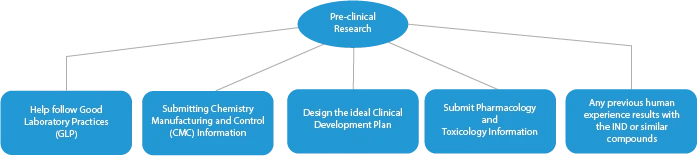
- Investigación/ensayos preclínicos
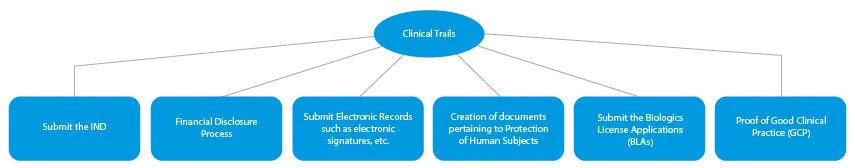
- Ensayos clínicos
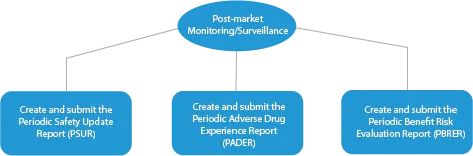
- Seguimiento/vigilancia postcomercialización
Cada fase del desarrollo de un medicamento requiere una serie de documentos que deben presentarse a las autoridades sanitarias. A continuación se describe cómo un proveedor de servicios de regulación establecido puede ayudar en todas las fases.
Última palabra
Con el aumento de la esperanza de vida de la población mundial, existe la necesidad de descubrir nuevos medicamentos. La innovación en el campo de las ciencias de la vida ha dado lugar a varios inventos en medicamentos que salvan vidas. Muchos de ellos se encuentran en diversas fases de fabricación. Sea cual sea la fase en la que se encuentre su producto, colaborar con un proveedor de servicios normativos global como Freyr, que cuenta con experiencia en el registro de medicamentos innovadores, puede ayudarle a evitar el incumplimiento normativo y garantizar que los nuevos medicamentos reach mercado a tiempo. Manténgase informado. Manténgase en cumplimiento.









