
Las autorizaciones de uso de emergencia (EUA) son importantes para que los pacientes puedan acceder más rápidamente a medicamentos que salvan vidas. Han sido útiles para hacer frente a pandemias como la de COVID-19. La Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA) puso en marcha una iniciativa en 2004, y la EUA entró en vigor cuando la sección 564 de la Ley Federal de Alimentos, Medicamentos y Cosméticos fue modificada por la Ley Project BioShield. Este programa es una medida adoptada por la FDA proteger la salud pública garantizando la seguridad, la eficacia y la calidad de los productos médicos, al tiempo que se abordan las emergencias médicas y las amenazas emergentes para la salud pública.
us mejor en las siguientes líneas.
Descifrar la EUA
La vía EUA es un medio para facilitar el acceso a las contramedidas médicas en situaciones de emergencia declaradas. El Comisionado de la FDA autorizar lo siguiente en tales situaciones:
- El uso autorizado de productos médicos no aprobados.
- El uso no autorizado de productos médicos autorizados.
Los productos cubiertos por la EUA incluyen vacunas, fluidos intravenosos, fármacos, dispositivos, pruebas, etc., y pueden utilizarse para diagnosticar, tratar o prevenir enfermedades potencialmente mortales. Los productos obtienen la EUA si cumplen los siguientes criterios:
- Prueba de una enfermedad potencialmente mortal.
- Los datos científicos aportan pruebas suficientes de que el producto es eficaz para el uso previsto.
- Los beneficios del producto superan a los riesgos (también conocidos como pruebas de seguridad).
- Falta de productos alternativos.
Se recomienda a los patrocinadores que comprendan los requisitos FDAcon antelación para que sigan el mejor proceso normativo y garanticen una presentación sin errores de la autorización de uso de emergencia (EUA). A continuación se incluye la información obligatoria que el patrocinador debe compartir en la solicitud.
Datos que debe presentar el patrocinador a la FDA la autorización de uso de emergencia (EUA)
- Descripción del producto y uso previsto.
- El estado de aprobación del producto por parte de la FDA.
- Información sobre seguridad y eficacia, como datos clínicos y no clínicos, etc.
- Informe de análisis de riesgos y beneficios.
- Datos sobre química, fabricación y controles (CMC).
- Información sobre la posología, contraindicaciones, advertencias y efectos adversos para la distribución del producto médico en cuestión.
¿Cómo emite la FDA las EUA?
A continuación se ofrece una breve interpretación esquemática del ciclo de vida de la EUA:
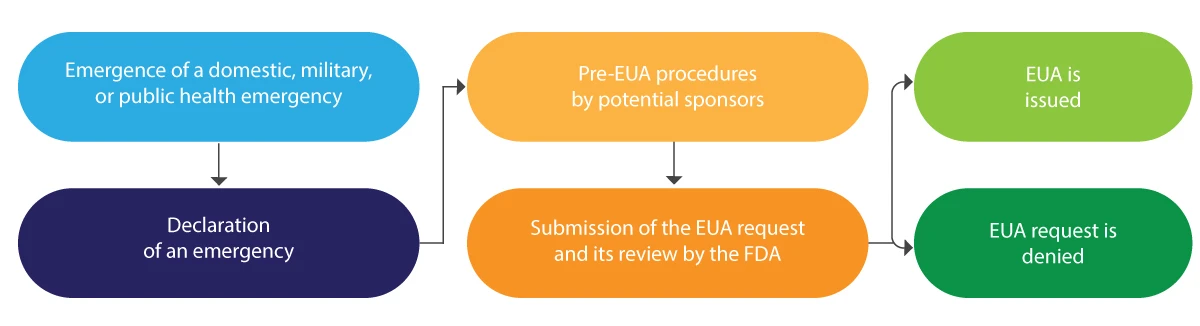
La EUA suele emitirse por un período limitado y, al finalizar la emergencia, la FDA la revoca.
EUA y COVID-19
El secretario de Salud y Servicios Humanos (HHS) declaró la COVID-19 como pandemia el 31 de enero de 2020. Desde entonces, la FDA desempeñado un papel fundamental en la aprobación de varias vacunas y kits de pruebas caseras bajo la vía de la autorización de uso de emergencia (EUA) para hacer frente al brote mundial en curso.
Con la aparición de nuevas variantes del COVID-19, toda la industria farmacéutica está trabajando arduamente para frenar la propagación y reducir las tasas de mortalidad. Se necesitan nuevos productos médicos y aprobaciones más rápidas por parte de las autoridades reguladoras mundiales para reducir el tiempo de comercialización. Según los expertos, la vía de la autorización de uso de emergencia (EUA) para registrar nuevos productos médicos/medicamentos es el camino a seguir. Otras autoridades sanitarias, como la Agencia Europea de Medicamentos (EMA), la Central Drugs Standard Control Organization CDSCO) y la Saudi Food and Drug Authority SFDA), entre otras, también han implementado la vía de la EUA para agilizar las aprobaciones.
Si usted es un fabricante de medicamentos y está buscando una autorización de uso de emergencia (EUA) para su producto que salva vidas, necesitará un proveedor de soluciones normativas experto. Reach con Freyr acelerar el tiempo de comercialización y garantizar el cumplimiento normativo.









