
El Programa de Auditoría Dispositivos Médicos (MDSAP) permite a una organización auditora reconocida (AO) realizar una única auditoría del Quality Management System (QMS) Dispositivos Médicos . Proporciona los requisitos reglamentarios pertinentes para cinco países, a saber, Brasil (ANVISA), Estados Unidos (FDA), Japón (PMDA), Canadá (Health Canada) y Australia (TGA). Además de las autoridades reglamentarias participantes, varios otros socios internacionales (los observadores oficiales y los miembros afiliados) participan en el MDSAP.
MDSAP es obligatoria Health Canada los dispositivos de clase II, III y IV según Health Canada , pero es voluntaria para los otros cuatro países. Ha promovido la transparencia y la armonización normativa entre las autoridades participantes y ha minimizado la necesidad de múltiples auditorías, lo que ha permitido ahorrar tiempo y recursos a Dispositivos Médicos . Para ofrecerle una mejor perspectiva del MDSAP , aquí hemos intentado responder a las quince (15) preguntas más frecuentes.
- ¿Por qué fue MDSAP el cuando ya existe una ISO 13485 aceptada a nivel mundial?
MDSAP desarrolló para reducir la carga que suponen las auditorías reglamentarias para Dispositivos Médicos y para promover una mayor armonización de los enfoques reglamentarios y los requisitos técnicos basados en normas internacionales y mejores prácticas. Se centra en aportar coherencia, previsibilidad y transparencia a los programas reglamentarios mediante la normalización de los procedimientos y prácticas de los organismos reguladores y las organizaciones de auditoría independientes.
La auditoría se basa en los requisitos del SGC según ISO 13485 y en los requisitos reglamentarios del país participante en el que se comercializarán los productos sanitarios.
- ¿Cuáles son los criterios de elegibilidad para someterse a una MDSAP ?
Cualquier Dispositivos Médicos que desee comercializar sus productos en los países participantes puede someterse a una MDSAP . No obstante, cada autoridad reguladora puede establecer criterios de exclusión para determinadas condiciones si lo considera necesario.
Por ejemplo, en Japón, las excepciones para poder optar a la ayuda son:
- Un centro de fabricación registrado (RMS) que fabrica productos sanitarios a partir de tejidos humanos o animales.
- Un RMS que fabrica IVD radiactivos, y
- Establecimiento de un Titular de la Autorización de Comercialización (TAC)
- ¿La MDSAP incluye productos combinados?
Los productos sanitarios que incluyen medicamentos (sustancias medicinales) o productos biológicos (por ejemplo, materiales de origen animal que se han vuelto inviables, o tejidos, células o sustancias de origen microbiano o recombinante, sangre humana o extractos de sangre humana o productos sanguíneos, etc.) se consideran productos combinados y pueden incluirse en el ámbito de una MDSAP .
Sin embargo, debido a las diferencias en la forma en que se regulan estos productos en las jurisdicciones de las autoridades reguladoras participantes, es posible que los informes MDSAP y los documentos de certificación MDSAP no se consideren una alternativa a los requisitos de inspección y evaluación en algunas jurisdicciones.
Australia: los productos combinados están sujetos a una inspección externa de la TGA en virtud de la evaluación de conformidad australiana. Sin embargo, una MDSAP eficaz puede reducir las inspecciones de estos dispositivos.
Brasil, Japón: los productos combinados considerados dispositivos médicos se incluyen en MDSAP, ya que no existen requisitos específicos en materia de sistemas de gestión de la calidad.
Canadá: MDSAP cubre los requisitos del sistema de gestión de calidad (SGC) para los productos combinados considerados dispositivos médicos.
EE. UU.: MDSAP no se consideran alternativas a FDA para productos combinados.
- ¿Puedo seleccionar el país en el que se realizará la MDSAP ?
Sí, la auditoría se realiza de acuerdo con el alcance declarado en la solicitud de servicios de certificación. Se espera que Dispositivos Médicos cumplan con las normativas solo en las jurisdicciones donde se comercializan sus productos.
- Soy un Dispositivos Médicos de EE US y tengo la intención de comercializar mi dispositivo solo en Japón. Estoy a punto de someterme a una MDSAP . ¿Debo cumplir también con los requisitos de otros países?
No, Dispositivos Médicos solo deben cumplir ISO 13485 y normativas de ISO 13485 en las jurisdicciones en las que se comercializan sus productos.
- Mi organización auditora (OA) y mi organismo notificado europeo son el mismo. Puedo ser auditado por ambos al mismo tiempo?
Si su AO y el organismo notificado europeo son los mismos, la evaluación de conformidad puede realizarse después de llevar a cabo la MDSAP , no simultáneamente. Los organismos notificados europeos son observadores del MDSAP, y la evaluación de conformidad se lleva a cabo según el EU MDR . En el caso MDSAP, la evaluación se realiza según los requisitos de ISO 13485 los requisitos reglamentarios de los países participantes en el ámbito de aplicación.
- ¿Cuál es la diferencia entre las evaluaciones de las fases I y II?
El proceso de auditoría MDSAP consta de dos etapas. La auditoría inicial, también denominada auditoría de certificación inicial, consta de las auditorías de la Etapa I y la Etapa II.
La auditoría de fase I incluye la revisión de la documentación y la evaluación de la preparación del Dispositivos Médicos para someterse a una auditoría de fase II.
La auditoría de Fase II se realiza para verificar si se aplican todos los requisitos aplicables de la ISO 13485 y otros requisitos reglamentarios de la autoridad reguladora en el ámbito de aplicación.
- ¿Cuántos auditores puedo esperar para una MDSAP ?
La determinación del tiempo de auditoría especifica cómo determinar la duración de la auditoría in situ en días-hombre. AO decide cuántos auditores compondrán el equipo de auditoría. Por ejemplo, una auditoría de (06) días-hombre puede completarse en tres (03) días por un equipo de dos (02) auditores.
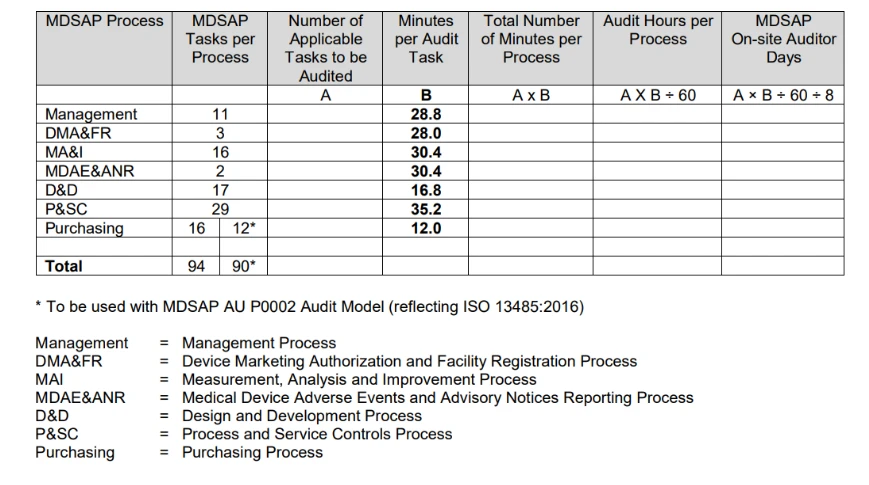
- ¿Cómo se programa la MDSAP ?
El Procedimiento de determinación del tiempo de auditoría, publicado por la FDA, resume el proceso de determinación de la duración del cálculo de la auditoría en la siguiente tabla.
El cálculo de la duración de la auditoría se basa principalmente en el número de tareas de auditoría aplicables asociadas al tipo de auditoría que se va a realizar y a las actividades específicas de la organización que se van a auditar.
Para obtener información detallada al respecto, puede consultar MDSAP .
- ¿Existe alguna guía o lista de verificación a la que pueda acceder para garantizar el cumplimiento de una MDSAP ?
Sí, puede acceder al documento MDSAP Approach» (Enfoque de auditoría MDSAP). Se trata de una guía bien organizada publicada por la USFDA hace referencia a secciones específicas de ISO 13485:2016 y a las normativas pertinentes publicadas por la TGA de Australia, ANVISA de Brasil, Health Canada de Canadá,PMDA de Japón y laFDA US
- ¿Cuál es el papel de un observador en una MDSAP ?
MDSAP es una autoridad reguladora a la que se le permite asistir a reuniones, evaluaciones y otras actividades, pero que no utiliza los MDSAP . Los observadores están representados en el Consejo de Autoridades MDSAP (RAC) MDSAP por un directivo de alto nivel.
- ¿Cuáles son los siguientes pasos que debo dar si he recibido una calificación igual o superior a 4?
El sistema de calificación se da a las no conformidades observadas durante la auditoría por AO. Una puntuación de 4 o 5 indica un alto riesgo de intervención. Debe presentar un plan de corrección para cada no conformidad registrada en un plazo de 15 días naturales a partir de la fecha de emisión del informe de no conformidad. El plan de corrección debe incluir los resultados de la investigación de la no conformidad, sus causas y las medidas correctivas previstas para evitar que se repita. Las pruebas de la aplicación del plan/acción de corrección deben presentarse en un plazo de treinta (30) días naturales a partir de la fecha de finalización de la auditoría.
- ¿Existe alguna diferencia en el proceso de abordar la auditoría por parte de un auditor interno frente a un AO?
MDSAP un enfoque basado en procesos. Es probable que la AO examine los vínculos y las conexiones, mientras que un auditor interno podría centrarse más en un aspecto funcional cada vez. Por lo tanto, la AO podría encontrar una no conformidad en un área funcional y buscar respuestas en otra área funcional diferente. Sin embargo, seguir el enfoque basado en procesos podría resultar perjudicial durante una auditoría interna.
- ¿Puedo recurrir ante el AO si puedo demostrar que una disconformidad registrada no es válida?
AO cuenta con un proceso de apelación o disputa, que puede utilizar si puede demostrar que una no conformidad registrada no es válida. Sin embargo, las calificaciones asignadas a las no conformidades no pueden modificarse debido a acciones correctivas. Sólo pueden modificarse basándose en pruebas que demuestren que no eran válidas.
- ¿Cuánto tiempo es válido el MDSAP ?
Dispositivos Médicos certificados bajo el MDSAP serán auditados anualmente, de acuerdo con un ciclo de certificación de tres años. La auditoría inicial es una auditoría completa del sistema de gestión de calidad (SGC) Dispositivos Médicos . A esta le siguen auditorías de vigilancia realizadas anualmente durante dos (02) años consecutivos. El ciclo se reinicia con una auditoría de recertificación en el tercer año.
Para obtener más información sobre nuestros MDSAP , póngase en contacto con Freyr hoy mismo para concertar una llamada con nuestros expertos.









