
Las empresas farmacéuticas que buscan nuevas perspectivas de negocio encuentran en Corea del Sur un mercado atractivo con una industria farmacéutica en rápido crecimiento. Con más de novecientos (900) nuevos medicamentos en fase de desarrollo y exportaciones por valor de 3.100 millones de dólares, Corea del Sur ofrece un enorme potencial para la fabricación de grandes productos farmacéuticos.
En Corea del Sur, presentar una solicitud de nuevo fármaco (NDA) o una solicitud de licencia biológica (BLA) es un paso fundamental para comercializar nuevos productos farmacéuticos. El Ministerio de Seguridad Alimentaria y Farmacéutica (MFDS) es el encargado de revisar y autorizar las NDA y las BLA en Corea del Sur. El procedimiento de revisión puede durar hasta ciento ochenta (180) días, pero si el medicamento se designa como de revisión prioritaria o de vía rápida, puede acortarse.
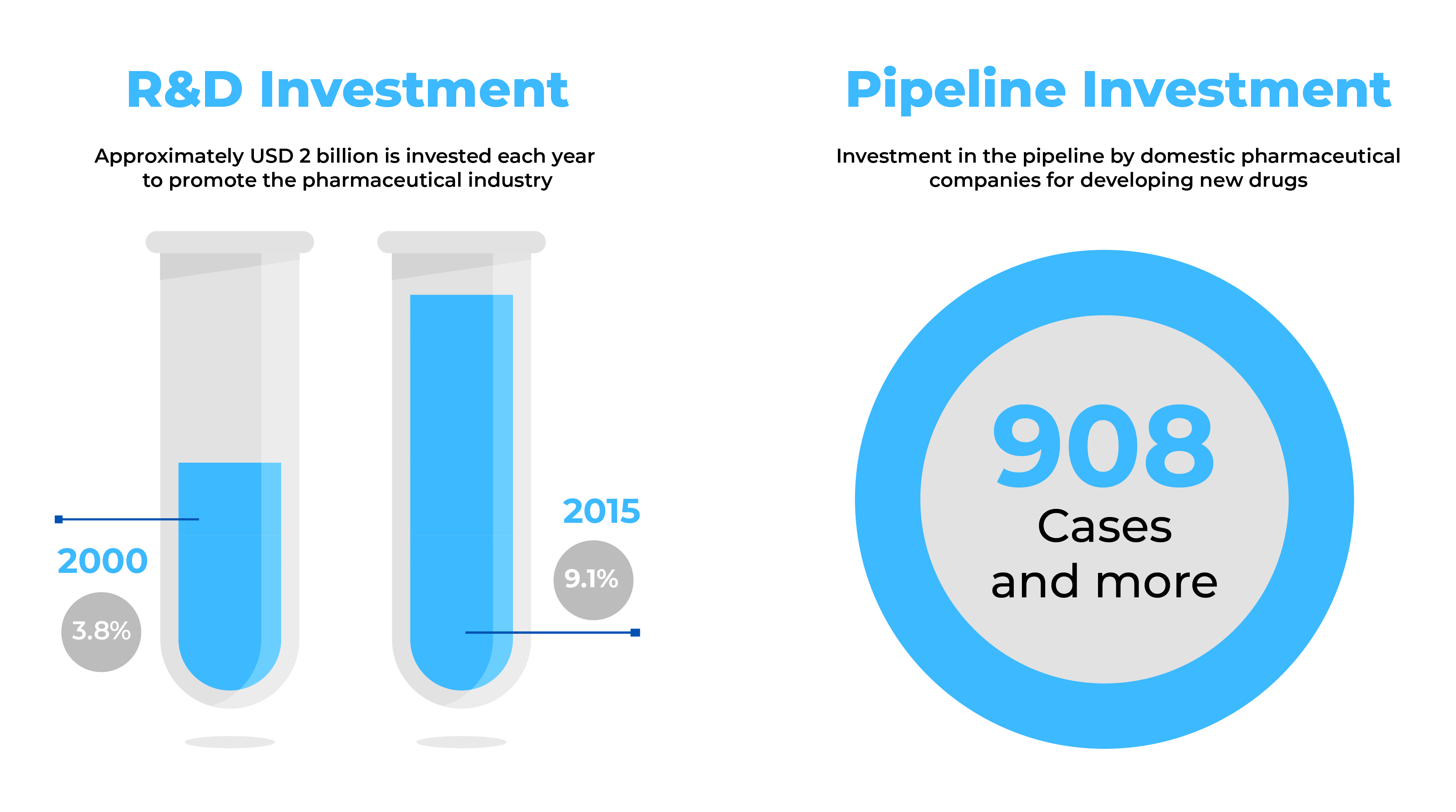
Fuente: Health Industry Trends-September 2014 & Global data (2017)
BLA en Corea del Sur ofrecen ventajas tales como un proceso de aprobación más rápido, regulaciones y requisitos claros, incorporación de evidencia del mundo real (RWE) y exenciones para medicamentos huérfanos. Sin embargo, elBLA en Corea del Sur puede ser complejo y llevar mucho tiempo. El proceso de presentación de una solicitud de nuevo fármaco (NDA) o una solicitud de licencia biológica (BLA) en Corea del Sur implica varios pasos.
He aquí un resumen del proceso:
- Pruebas preclínicas: Antes de que un fármaco pueda evaluarse en seres humanos, primero debe probarse en animales para garantizar su seguridad y eficacia. Normalmente, estas pruebas se realizan en animales.
- Ensayos clínicos: Una vez concluida la investigación preclínica, el medicamento pasa a los ensayos clínicos en humanos. Estos estudios se dividen en tres (03) fases, cada una con un número mayor de participantes.
- BLA : Una vez completados los estudios clínicos, el patrocinador puede presentar una NDA BLA Ministerio de Seguridad Alimentaria y Farmacéutica (MFDS) de Corea del Sur. La solicitud debe incluir los cinco (05) módulos del Documento Técnico Común Electrónico (eCTD), que abarcan datos no clínicos, clínicos y de química, fabricación y controles (CMC).
- Aprobación: Si la MFDS determina que el medicamento es seguro y eficaz,BLA aprobará laBLA . Una vez aprobado, el medicamento podrá anunciarse y venderse en Corea del Sur.
¿Todavía no responde a todas tus preguntas?
Dejemos que los expertos lo aclaren.
Para obtener una perspectiva detallada sobreBLA en Corea del Sur, Freyr programado un seminario web gratuito con nuestros expertos de Corea del Sur. Únase us el seminario «Descripción general delBLA en Corea del Sur», programado para el 29 de noviembre de 2023, a las 11:30 a. m. IST (ROW) y a las 10:00 a. m. EST | 3:00 p. m. GMT | 4:00 p. m. CET (América y EE. UU.). ¡Regístrese ahora! Manténgase a salvo. Manténgase informado.
Para las regiones AMR y UE
10: 00 AM EST | 3:00 PM GMT | 4:00 PM CET
Para RoW
11:30 HORAS IST









