
Después de casi dos (02) décadas desde la publicación del primer borrador de la guía, la Administración de Alimentos y MedicamentosUS FDA) finalizó la guía sobre farmacocinética poblacional (PK) en febrero de 2022. El último borrador explica la aplicación de la PK poblacional en el desarrollo de fármacos y ofrece recomendaciones sobre la individualización terapéutica. La guía se aplica a las solicitudes de nuevos fármacos en investigación (IND), las solicitudes de nuevos fármacos (NDA), las solicitudes de licencias biológicas (BLA) y las solicitudes abreviadas de nuevos fármacos (ANDA).
Los patrocinadores/fabricantes de fármacos deben incluir los datos del análisis PK poblacional en las solicitudes de comercialización para simplificar las actividades posteriores a la comercialización. También pueden ser cruciales para responder a las preguntas reglamentarias de las autoridades sanitarias.
Comprender la PK de la población
El estudio de la variabilidad en las concentraciones de fármacos dentro de una población de pacientes que reciben dosis clínicamente relevantes de un fármaco específico se define como PK poblacional. Su objetivo es identificar y cuantificar las fuentes de variabilidad útiles para la fabricación y recomendación de dosis de dichos fármacos.
La siguiente ilustración puede servir de referencia para comprender todo el proceso de PK poblacional:
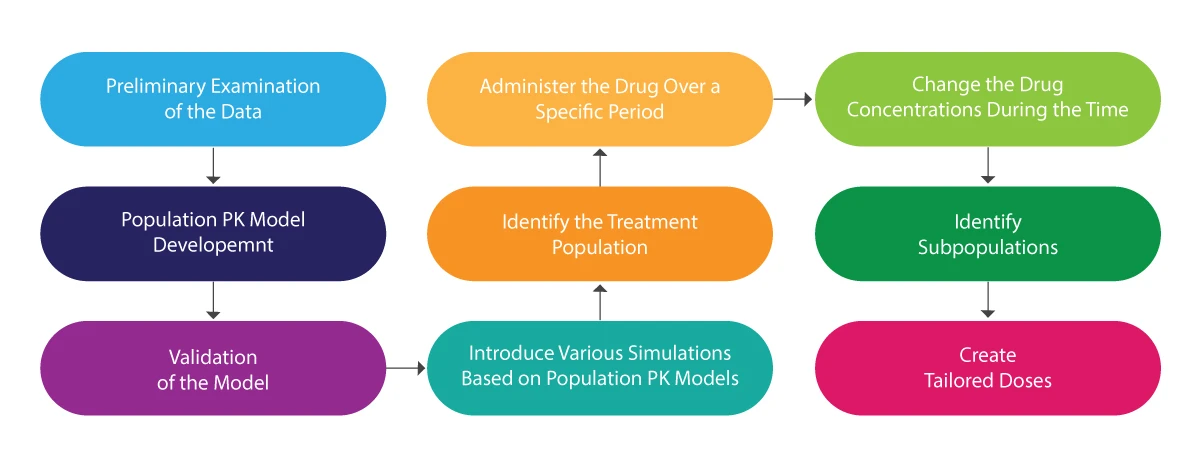
Análisis PK de la población - ¿Cómo ayuda?
- Ayuda a diseñar regímenes de dosificación personalizados.
- Proporciona una estimación fiable de la covariable (una variable cuyo cambio puede predecirse en una investigación/estudio y puede utilizarse para predecir el resultado de dicho estudio).
- Tiene en cuenta factores como la demografía, el entorno, la biología, los medicamentos concomitantes (otros fármacos que toman los pacientes durante el ensayo) y la concentración del fármaco.
- Útil para diseñar ensayos clínicos más seguros y cualitativos, incluidos los pediátricos.
- Obtener la matriz de exposición para realizar el análisis exposición-respuesta.
Resumen de la guía definitivaFDA US sobre farmacocinética poblacional
El borrador final ofrece una visión de la opinión actual FDAsobre los datos del análisis farmacocinético poblacional y las presentaciones de modelos para ayudar a tomar decisiones normativas. A continuación se ofrece una breve descripción general del borrador:
Etiquetado - Proporciona recomendaciones sobre la incorporación de la información apta de dicho análisis en el etiquetado. Los resultados deben presentarse en la sección "Farmacología clínica" y resumirse en otras secciones del etiquetado, según proceda.
Contenido: también FDA detallado el contenido y el formato pertinente que debe seguirse para la presentación de informes farmacocinéticos poblacionales a la FDA .
Toma de decisiones reglamentarias - Los informes de PK de la población que son útiles para tomar decisiones reglamentarias deben incluirse en el Módulo 5 del Documento Técnico Común electrónico (eCTD).
Seguir avanzando
Se ha pedido a los patrocinadores que necesiten asesoramiento sobre el uso del análisis farmacocinético poblacional en su proceso de desarrollo de fármacos o para responder a preguntas reglamentarias que lo hagan en sus reuniones importantes con la Agencia. Además, es imprescindible garantizar un buen rendimiento del modelo para obtener resultados precisos. Esto se puede lograr utilizando datos farmacocinéticos suficientes sobre la población de pacientes específica y las subpoblaciones pertinentes.
Para los fabricantes y patrocinadores de medicamentos, puede resultar complicado presentar informes farmacocinéticos poblacionales precisos en formato eCTD y cumplir con las normativas de etiquetado. Reach con un experto en normativa como Freyr, que puede ayudarle con sus presentaciones y actividades de etiquetado normativo .









