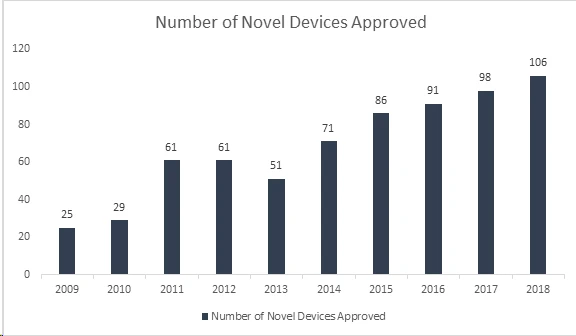
Czy wiesz, że US Agencja US i Leków (FDA) ustanowiła kolejny rekord, zatwierdzając w 2018 r. 106 nowych urządzeń, co sprawia, że był to najbardziej udany rok dla wyroby medyczne? Dzięki temu osiągnięciu FDA swój 40-letni rekord ustanowiony w 2017 r., kiedy to zatwierdziła 99 nowych urządzeń, wykazując ciągły wzrost w ciągu ostatnich 8 lat. Wśród zatwierdzonych urządzeń znajduje się szereg innowacyjnych produktów, takich jak automatyczne systemy podawania insuliny dla dzieci, najmniejsza na świecie zastawka serca dla noworodków, pierwsza mobilna aplikacja medyczna pomagająca w leczeniu uzależnienia od opioidów i innych substancji oraz technologie sztucznej inteligencji służące do diagnozowania retinopatii cukrzycowej.
FDA zawsze FDA bezpieczeństwo i innowacyjność wyroby medyczne zapewnić ich wysoką jakość. Aby nadążyć za rosnącą liczbą zatwierdzanych nowych urządzeń i zapewnić ich bezpieczeństwo, FDA „unowocześnić” proces zatwierdzania wyrobów medycznych. Według agencji unowocześnienie procesu zatwierdzania może wymagać powołania nowego organu. W 2018 r. FDA Centrum Urządzeń i Zdrowia Radiologicznego (CDRH) opublikowały wspólny dokument, w którym stwierdzono, że 510(k) jest jednym z dwóch rodzajów wniosków dodanych do definicji nowych urządzeń. Wraz z tym, do definicji nowych urządzeń dodano również zwolnienia z wymogów dotyczących urządzeń humanitarnych (HDE) po zmianach wprowadzonych do programu przełomowych urządzeń medycznych CDRH w związku z ustawą 21st Century Act.
Propozycja FDA CDRH jest odpowiedzią na potencjalną potrzebę uzyskania nowych uprawnień w celu unowocześnienia procesu 510(k). Motywem tej propozycji jest ograniczenie stosowania urządzeń referencyjnych, jako zasadniczo równoważnych (SE), które mają ponad 10 lat, w celu promowania innowacji. Jest to krok naprzód w stosunku do wytycznych opublikowanych przez agencję w kwietniu 2018 r. Projekt został opublikowany przez FDA zaproponowania rozszerzenia programu skróconego 510(k) w CDRH FDApod tytułem „Safety and Performance-based Pathway” (Ścieżka oparta na bezpieczeństwie i wydajności). Został on wprowadzony w celu zmniejszenia obciążenia przepisami dotyczącymi wyroby medyczne. Podejście to ma również na celu zwiększenie efektywności przeglądu wniosków 510(k), a tym samym zmniejszenie presji na agencję.
Oto niektóre z najważniejszych wskazówek:
- Nowa ścieżka ocenia bezpieczeństwo i skuteczność urządzeń w odniesieniu do ustalonych standardów bezpieczeństwa i wskaźników wydajności
- Pomimo nowych standardów, urządzenia będą musiały być zgodne z istniejącymi normami, aby mogły zostać wprowadzone na rynek
- Nowoczesna technologia będzie testowana pod kątem nowoczesnych standardów
- Podejście to zwiększy konkurencję w zakresie opracowywania bezpieczniejszych urządzeń
Liczba wyroby medyczne do zatwierdzenia wzrosła wykładniczo na przestrzeni lat. Dało to FDA szerokie pole FDA przyjęcia i wdrożenia innowacyjnych środków mających na celu usprawnienie ścieżek zatwierdzania. Agencja jest głęboko przekonana o zaletach tej propozycji, ale reakcja branży nie jest jeszcze znana.
W związku z tym, że FDA opracowuje nowe wytyczne dotyczące ulepszania rejestracji wyrobów medycznych, producenci wyrobów medycznych muszą śledzić te zmiany i odpowiednio do nich dostosowywać swoje działania. Bądź na bieżąco. Działaj zgodnie z przepisami.