Jednostka Oceny Zgodności (CAB) przeprowadza ocenę zgodności różnych interesariuszy systemu łańcucha dostaw urządzeń medycznych. Jednostka Oceny Zgodności (CAB) w Malezji przeprowadza szeroko zakrojone audyty i ocenia wszystkie obowiązujące elementy określone przez Urząd ds. Wyrobów Medycznych (MDA) w Malezji oraz weryfikuje zgodność urządzenia z odpowiednimi normami.
W tej części serii blogów omówiona zostanie rola CAB w rejestracji i zatwierdzaniu urządzeń w Malezji. Można również uzyskać wgląd w wymagania MDA dotyczące certyfikacji CAB, które zostały omówione w pierwszej części.
Ocena zgodności to systematyczne i ciągłe badanie dowodów i procedur w celu zapewnienia bezpieczeństwa, wydajności, korzyści i ryzyka związanego z wyroby medyczne. Zapewnia również zgodność produkcji z podstawowymi zasadami bezpieczeństwa i wydajności (EPSP) oraz wymogami ustawy o wyrobach medycznych z 2012 r. (ustawa 737). Klasyfikacja wyrobu medycznego określa procedury oceny zgodności, które należy przeprowadzić. Ocena zgodności staje się bardziej rygorystyczna wraz ze wzrostem ryzyka związanego z wyrobem medycznym, dlatego konieczna jest ocena ryzyka związanego z wyrobem medycznym.
CAB przeprowadzają różne rodzaje ocen w zależności od operacji biznesowych prowadzonych przez organizację i zakresu aplikacji. Obejmują one:
- Ocena dokumentacji technicznej
- Ocena systemów zarządzania jakością pod kątem ISO 13485
- Certyfikacja dobrej praktyki dystrybucyjnej wyroby medyczne GDPMD)
- Pełna ocena zgodności na potrzeby rejestracji urządzenia
- Uproszczona weryfikacja rejestracji urządzeń
OOZ odgrywają kluczową rolę dla każdej zainteresowanej strony w systemie łańcucha dostaw, w tym producentów urządzeń, importerów, dystrybutorów, autoryzowanych przedstawicieli (AR) i innych.
Importerzy, dystrybutorzy i autoryzowani przedstawiciele wymagają, aby ich zakłady były zarejestrowane w MDA w celu prowadzenia działalności. Certyfikacja GDPMD jest niezbędnym warunkiem wstępnym, który należy złożyć wraz z wnioskiem o zezwolenie na prowadzenie działalności. CAB przeprowadzają ocenę zgodności systemów jakości tych podmiotów pod kątem zgodności z przepisami GDPMD określonymi przez MDA przed wydaniem certyfikatu. Ocena ta obejmuje przegląd dokumentacji technicznej, a także audyt na miejscu w zakładach.
Producenci urządzeń są również zależni od CAB, aby ich urządzenia zostały zarejestrowane w MDA w Malezji. Producenci krajowi wymagają, aby ich zakłady produkcyjne były zarejestrowane w MDA.
Oprócz rejestracji zakładów, jednostki certyfikujące odgrywają również rolę w rejestracji wyrobów wyroby medyczne w MDA. wyroby medyczne zatwierdzenia w krajach referencyjnych podlegają weryfikacji przez jednostkę certyfikującą, natomiast wyroby nieposiadające zatwierdzeń w krajach referencyjnych podlegają pełnej ocenie przez jednostkę certyfikującą.
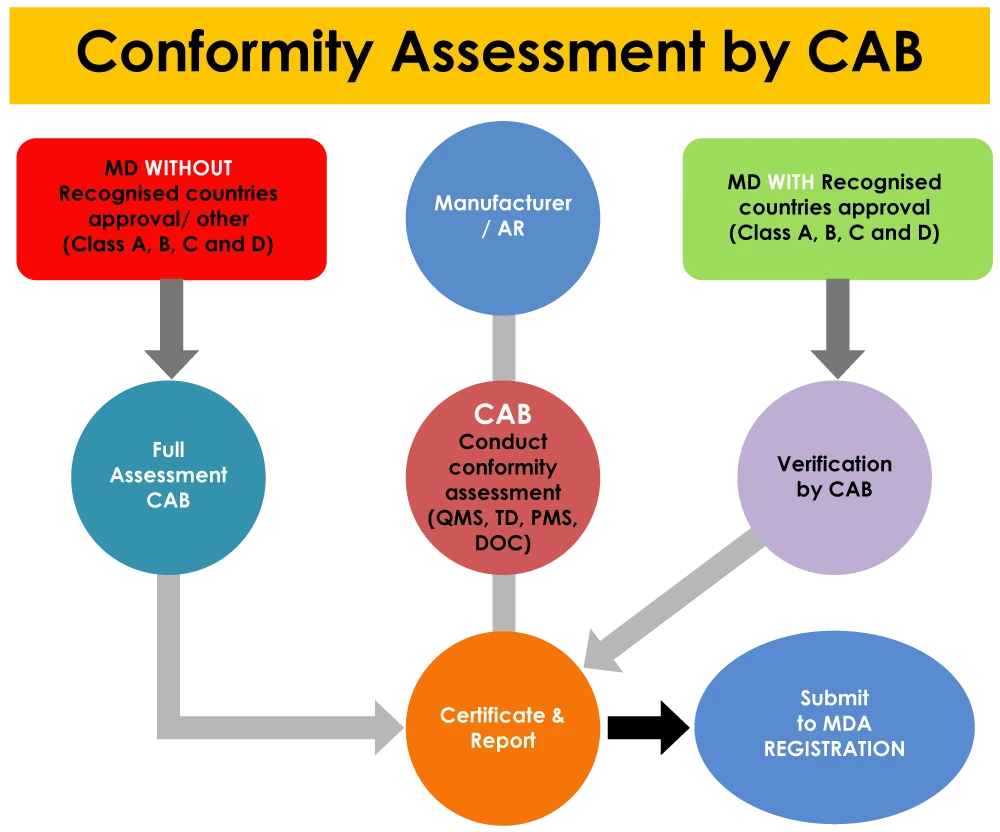
W przypadku stwierdzenia jakichkolwiek niezgodności w systemie QMS, PMS i kompletnej dokumentacji urządzenia (w tym w każdym raporcie z testów), istnieje duże prawdopodobieństwo, że wniosek zostanie odrzucony przez CAB.
Przeczytaj część 1 artykułu, aby poznać wymagania MDA i procedury zatwierdzania certyfikacji CAB.
Chcesz wprowadzić swoje urządzenie medyczne lub produkt do diagnostyki in vitro na rynek malezyjski? Chcesz dowiedzieć się więcej o roli i obowiązkach CAB w zakresie rejestracji urządzeń? Reach z ekspertem ds. regulacji. Bądź na bieżąco. Dbaj o zgodność z przepisami.









