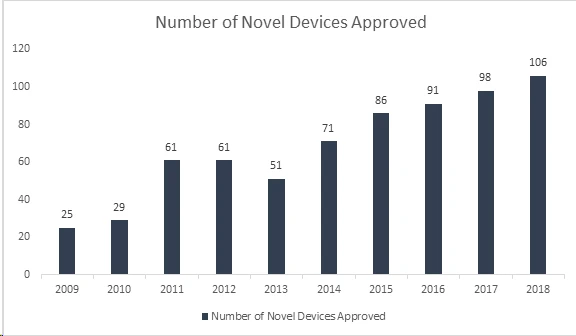
¿Sabías que la Administración US y Medicamentos US (FDA) ha vuelto a batir un récord al aprobar 106 dispositivos novedosos en 2018, lo que lo convierte en el año más exitoso para los dispositivos médicos? Con este logro, FDA superado su récord de 40 años establecido en 2017, cuando aprobó 99 dispositivos novedosos, lo que demuestra un crecimiento continuo durante los últimos 8 años. Entre los dispositivos aprobados se incluyen una serie de productos innovadores, como sistemas automatizados de dosificación de insulina para niños, la válvula cardíaca más pequeña del mundo para recién nacidos, la primera aplicación médica móvil para ayudar a controlar los trastornos por abuso de opiáceos y sustancias, y tecnologías de inteligencia artificial que diagnostican la retinopatía diabética.
FDA supsiempre FDA promovido la seguridad y la innovación de los dispositivos médicos para garantizar su alta calidad. Para mantenerse al día con el creciente número de aprobaciones de dispositivos novedosos y su seguridad, FDA previsto «modernizar» el proceso Dispositivos Médicos . Según la agencia, la modernización del proceso de autorización puede requerir una nueva autoridad. En 2018, FDA el Centro de Dispositivos y Salud Radiológica (CDRH) publicaron un documento conjunto en el que se afirmaba que el 510(k) era uno de los dos tipos de presentación añadidos a la definición de dispositivos novedosos. Junto con esto, también se añadieron las exenciones de dispositivos humanitarios (HDE) a la definición de dispositivo novedoso tras los cambios introducidos en Dispositivos Médicos innovador Dispositivos Médicos del CDRH debido a lasup del Siglo XXI.
La propuesta de la FDA el CDRH responde a la posible necesidad de buscar nuevas competencias para modernizar el proceso 510(k). El motivo de la propuesta es limitar el uso de dispositivos predicados, como sustancialmente equivalentes (SE), que tengan más de 10 años de antigüedad, con el fin de promover la innovación. Se trata de un paso adelante con respecto a las directrices publicadas por la agencia en abril de 2018. El borrador fue publicado por la FDA proponer la ampliación del programa abreviado 510(k) en el CDRH FDAbajo el título «Vía basada en la seguridad y el rendimiento». Se introdujo para reducir la carga de las disposiciones sobre los dispositivos médicos. El enfoque también pretende aumentar la eficiencia de la revisión de las solicitudes 510(k), reduciendo así la presión sobre la agencia.
Estos son algunos de los puntos más destacados de la orientación:
- La nueva vía evalúa la seguridad y eficacia de los dispositivos en función de unas normas de seguridad y unas métricas de rendimiento establecidas
- A pesar de las nuevas normas, los dispositivos tendrán que cumplir las normas vigentes para poder comercializarse
- La tecnología moderna se probará con normas modernas
- El planteamiento impulsará una mayor competencia para el desarrollo de dispositivos más seguros
El número de dispositivos médicos que se presentan para su autorización ha aumentado exponencialmente a lo largo de los años. Esto ha dado un amplio margen a la FDA adoptar y aplicar medidas innovadoras con el fin de mejorar los procesos de autorización. La agencia cree firmemente en las ventajas de esta propuesta, pero aún está por ver cuál será la respuesta del sector.
Dado que la FDA publica FDA nuevos documentos de orientación para actualizar Dispositivos Médicos , es necesario que Dispositivos Médicos estén al tanto de ellos y actúen en consecuencia. Manténgase al día. Cumpla con la normativa.