
Cuando un establecimiento extranjero se dedica a la producción de Dispositivos Médicos a los Estados Unidos (US), es obligatorio designar un US para dicho establecimiento. El US actúa como punto de contacto para cualquier comunicación US la Administración US y MedicamentosUS FDA) relacionada con el establecimiento registrado en el extranjero. Dado que estas comunicaciones pueden ser urgentes, es imprescindible que el US tenga un conocimiento exhaustivo de la FDA y sea capaz de asesorar al establecimiento extranjero sobre el cumplimiento de Dispositivos Médicos FDAen materia Dispositivos Médicos . Además, contar con un US independiente ayuda a evitar posibles conflictos de intereses que pueden surgir cuando se designa a un socio comercial como US . En este blog, profundizaremos en los detalles del registro de un establecimiento extranjero en laFDA US .
¿Qué es el registro de establecimientos?
El registro anual ante laFDA US FDA obligatorio para los fabricantes por contrato, importadores iniciales, reenvasadores/reetiquetadores, desarrolladores de especificaciones, etc., de establecimientos dedicados a la fabricación y distribución de dispositivos médicos destinados al mercado estadounidense, un procedimiento denominado «registro de establecimientos» (Título 21 CFR Parte 807).
Who debe solicitar el registro de establecimiento?
Los propietarios de instalaciones que se dedican a la fabricación y distribución de dispositivos médicos destinados a su uso en los US completar un registro anual ante laFDA US . Los tipos de propietarios que pueden solicitar el registro de establecimiento son:
- Propietarios de establecimientos domésticos
- Propietarios de establecimientos extranjeros
- Fabricantes por contrato
- Importadores iniciales
- Reempaquetadores/Etiquetadores
- Desarrolladores de especificaciones
¿Cuáles son los pasos del proceso de registro de establecimientos?
Para registrar un Dispositivos Médicos en laFDA US , debe seguir los pasos que se describen en el siguiente diagrama de flujo.
Figura 1: Etapas del proceso de registro de establecimientos
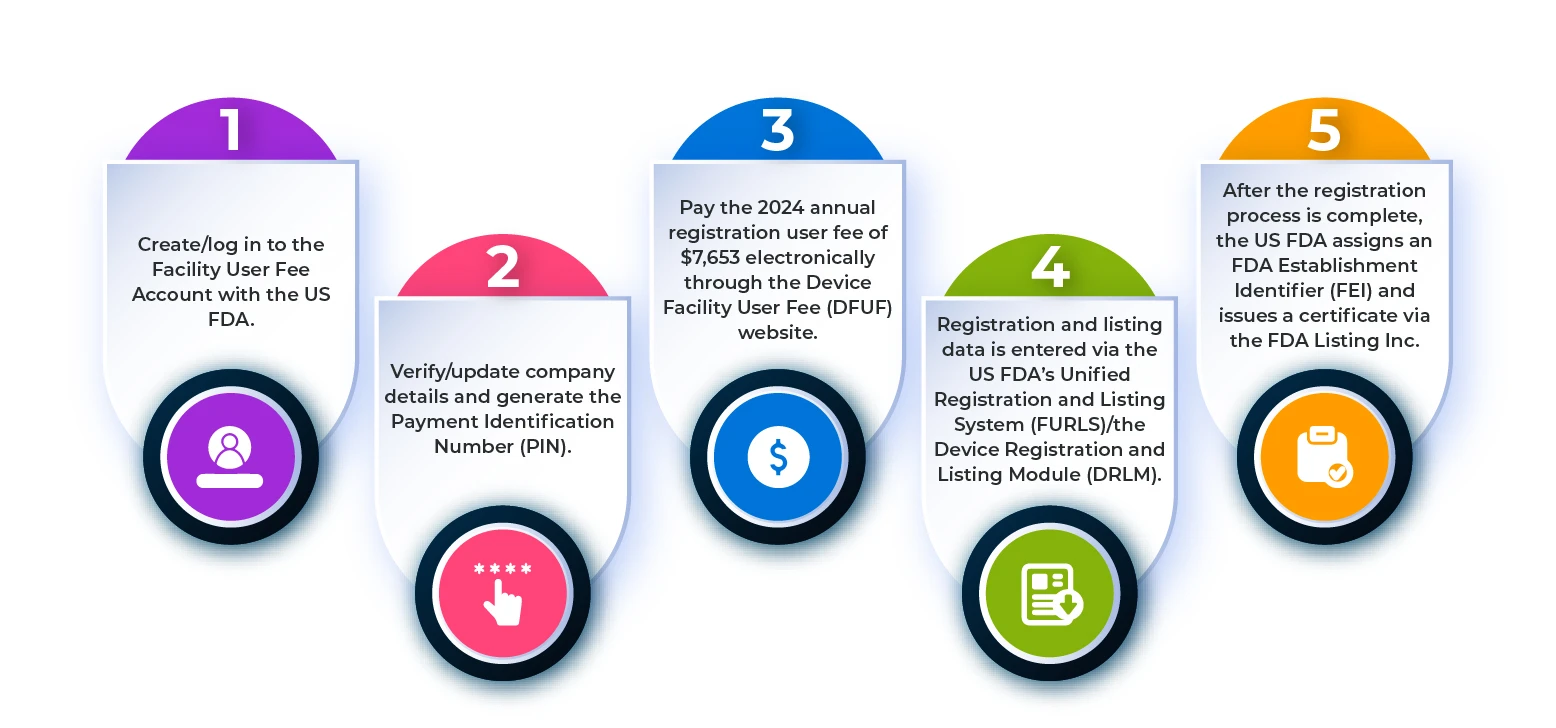
¿Cuáles son los requisitos de registro y cotización de establecimientos extranjeros?
Comprender la importancia de elegir un US independiente y experto ayudará a las empresas extranjeras a dar prioridad a la prevención de cualquier conflicto de intereses, lo cual es fundamental para las empresas a la hora de navegar por el complejo ámbito del FDA US . Las empresas extranjeras deben reforzar su comprensión de los requisitos previos para lograr el cumplimiento, fomentar asociaciones sólidas con US y sentar las bases para un proceso de registro fluido. La siguiente tabla resume los requisitos de registro y listado en función de las actividades de una empresa extranjera. También indica qué actividades conllevan una tasa de registro de la empresa.
Tabla 1: Requisitos de registro y cotización en función de las actividades de un establecimiento extranjero
| Actividad | Regístrese en | Lista | Tasa de pago | |
| Fabricantes por contrato (incluidos los envasadores por contrato) | SÍ 807.40 (a) | SÍ 807.40 (a) | SÍ | |
| Esterilizador por contrato | SÍ 807.40 (a) | SÍ 807.40 (a) | SÍ | |
| Fabricantes de dispositivos a medida | SÍ 807.20 (a) (2) | SÍ 807.20 (a) (2) | SÍ | |
| Dispositivo investigado en el marco de la exención para dispositivos en investigación (IDE) | NO 812.1 (a) | NO 812.1(a),807.40 (c) | NO | |
| Exportador extranjero de productos situados en un país extranjero | SÍ 807.40 (a) | SÍ 807.40 (a) | SÍ | |
| Fabricantes extranjeros (incluidos los ensambladores de kits) | SÍ 807.40 (a) | SÍ 807.40 (a) | SÍ | |
| Mantiene los archivos de reclamaciones según lo dispuesto en 21 CFR 820.198 | SÍ | SÍ | SÍ | |
| Fabricante de accesorios envasados o etiquetados para su distribución comercial con fines sanitarios a un usuario final | SÍ 807.20 (a) (5) | SÍ 807.20 (a) (5) | SÍ | |
| Fabricante de componentes que se distribuyen únicamente a un fabricante de productos terminados | NO 807.65 (a) | NO | NO | |
| Reetiquetadoras o reenvasadoras | SÍ 807.20 (a) (3) | SÍ 807.20 (a) (3) | SÍ | |
| Remanufacturador | SÍ | SÍ | SÍ | |
| Reprocesador de dispositivos de un solo uso | SÍ 807.20 (a) | SÍ 807.20 (a) | SÍ | |
| Desarrolladores de especificaciones | SÍ | SÍ | SÍ | |
El registro de establecimientos ante laFDA US FDA un requisito esencial para los establecimientos extranjeros que se dedican a la producción, venta, reenvasado o importación de productos sanitarios en EE US Este registro garantiza el cumplimiento de las estrictas normativas y estándaresFDA US Freyr ofrece un valioso apoyo a los establecimientos que buscan asesoramiento experto durante el proceso de registro. Aprovechando su experiencia y conocimiento de las normativasFDA US , Freyr ayuda a los establecimientos extranjeros a cumplir los requisitos de conformidad, lo que en última instancia conduce a una entrada más fluida y eficiente en elDispositivos Médicos US Dispositivos Médicos . Para obtener más información sobre el proceso de registro de establecimientos ante laFDA US , reach con nosotros hoy mismo. ¡Manténgase informado! ¡Cumpla con la normativa!









