24 de septiembre de 2016; con la fecha límite, a solo un mes de distancia para el cumplimiento del Identificador Único de Dispositivos (UDI) de Clase II, suponemos, si no es seguro, que todos Dispositivos Médicos están bien equipados con una hoja de ruta regulatoria completa. Además de tener un control firme sobre los requisitos previos de gobernanza, se espera que los fabricantes estén listos para la auditoría de cumplimiento. Desde la validación de los registros del identificador de dispositivo (DI) y del identificador de producto (PI) hasta el envío correcto de la GUDID, deben conocer bien los datos que deben enviar y los procedimientos que deben seguir. Tanto antes como después del envío, contar con un mejor conocimiento de los procedimientos puede proteger a los fabricantes de los retos correspondientes relacionados con la agregación de datos, el envío de registros DI y la gestión de informes de dispositivos, el seguimiento de los acuses de recibo de HA, etc.
Para equipar a los fabricantes con una mejor posición en tales escenarios, aquí ofrecemos una infografía de rápida comprensión sobre los retos del cumplimiento de UDI frente a las soluciones, que podría ahorrarle tiempo para descifrar las complejidades del cumplimiento y planificar mejor y estructurar la hoja de ruta.
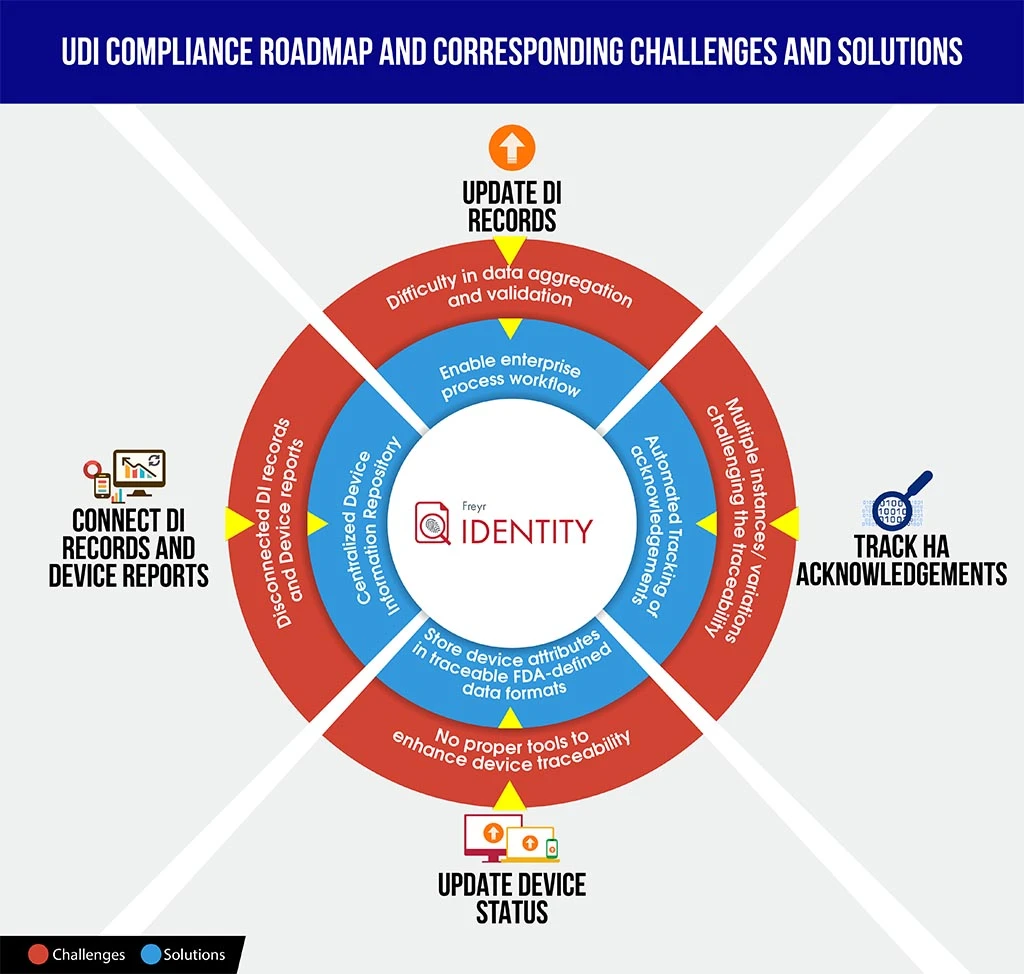
Para guiar a su organización a través de este complejo proceso de cumplimiento normativo, Freyr lo mejor de ambos mundos: una solución de software UDI totalmente configurable y bajo demanda,Freyr , así como un Centro de Excelencia UDI (CoE) que ofrece los mejores servicios UDI de su clase, rentables y personalizables, diseñados en función de sus requisitos únicos y exigentes.









