El Reglamento sobre productos sanitarios de la Unión Europea (EU MDR) 2017/745 define el ámbito de aplicación de los productos sanitarios estériles como aquellos productos que deben estar libres de microorganismos (bacterias, virus, etc.). Los productos de clase I con función estéril también pueden obtener una autocertificación, pero los requisitos difieren en comparación con otras subcategorías de productos de clase I.
Los requisitos para los dispositivos de clase I varían considerablemente desde la fabricación hasta la comercialización del dispositivo. Lo mismo se aplica a los dispositivos médicos de clase I con condiciones de esterilidad. Por ejemplo, si se trata de un dispositivo de clase I con una función de esterilidad, los requisitos para la fabricación y la implantación de un Quality Management System (QMS) considerablemente en comparación con los dispositivos de clase I con funciones de medición.
El objetivo de este artículo es proporcionar una lista de comprobación concisa a tener en cuenta a la hora de comercializar un producto de clase I en condiciones estériles en la Unión Europea. La lista de comprobación ayudará a los fabricantes a tomar decisiones informadas sobre diferentes aspectos.
¡Dos!
Conocer el alcance antes de fabricar
Según el Reglamento sobre EU MDR, los productos sanitarios con funciones estériles deben desarrollarse y fabricarse con procedimientos adecuados para garantizar su esterilidad hasta su comercialización. Los productos solo pueden reutilizarse tras someterse a procedimientos adecuados de limpieza, desinfección y esterilización.
Elegir las prácticas de esterilización correctas
Existen diferentes métodos de esterilización que un fabricante puede elegir para esterilizar el dispositivo. El método de óxido de etileno (EtO) se utiliza ampliamente para esterilizar dispositivos médicos. La elección del método de esterilización debe estar debidamente justificada. Algunas normas que los fabricantes pueden seguir para establecer, asegurar y mantener la esterilización son EN ISO 14937, ISO TS 21387, ISO TS 13004, ISO 11137 y otras.
Además, tenga en cuenta que la documentación del método de esterilización detallado, el método durante el proceso y la validación de datos debe realizarse con precisión. La información sobre la esterilización, como la temperatura de calentamiento, las condiciones de la sala, las validaciones del proceso, etc., debe proporcionarse de acuerdo con los EU MDR .
Conozca los requisitos y las directrices que debe seguir
Uno de los pasos fundamentales es documentar los requisitos técnicos y conocer las normas aceptadas por EU MDR. Por ejemplo, la norma EN 556 es la norma europea para dispositivos esterilizados. La norma EN 556 detalla los requisitos para designar un Dispositivos Médicos estéril. Además, la norma ISO TS 19930 especifica estrategias para garantizar la esterilidad de los dispositivos. Sin embargo, aún no se ha adoptado como norma de la UE.
Conozca su ruta
Para obtener el marcado CE, infórmese sobre la participación de los organismos notificados y la vía de evaluación de la conformidad que debe seguirse. Además, los productos sanitarios con condiciones estériles deben seguir los anexos IX y XI.
La participación de un Organismo Notificado es necesaria pero limitada. En el caso de los productos estériles, la participación de los organismos notificados se referirá al mantenimiento y la garantía de las condiciones de esterilidad. Por ejemplo, las evaluaciones de conformidad incluirán evaluaciones microbiológicas, métodos asépticos, etc.
Lo que no hay que hacer
No se pierda los requisitos de envasado y etiquetado

Existen requisitos adicionales para el cumplimiento de los requisitos de envasado y etiquetado en los productos estériles. Al cumplir los requisitos de envasado y etiquetado, no se debe olvidar la información que se debe colocar. El primer y más importante paso es colocar un símbolo de esterilidad (mencionado a continuación) en el etiquetado del dispositivo.
Debe incluirse información como la declaración de esterilidad, el método de esterilización, las instrucciones en caso de que el envase estéril se dañe o se abra involuntariamente, etc. Asimismo, debe incluirse la vida útil del producto estéril y el proceso de reesterilización (si procede). El número de identificación de un Organismo Notificado también debe figurar en el producto.
Algunos de los símbolos que deben añadirse (dependiendo de la aplicabilidad) en el etiquetado de productos sanitarios estériles son:
Símbolo | Indicación |
| Productos sanitarios estériles con método de esterilización aséptica |
| Productos sanitarios estériles con método de esterilización por óxido de etileno |
| Productos sanitarios estériles con método de esterilización por calor seco o vapor |
| Productos sanitarios estériles cuyo método de esterilización es el peróxido de hidrógeno vaporizado |
| Productos sanitarios estériles con método de esterilización por radiación |
| El dispositivo no puede esterilizarse de nuevo |
| El dispositivo no está esterilizado |
| No lo utilice si el envase está dañado |
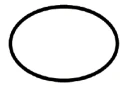
| Sistema de barrera estéril único |
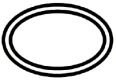
| Sistema de doble barrera estéril |
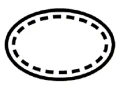
| Sistema de barrera estéril único con embalaje protector interior |
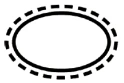
| Sistema de barrera estéril único con embalaje protector exterior |
No olvide los requisitos para la colocación posterior a la comercialización
Los productos estériles están obligados a mantener un registro de incidentes adversos en caso de que se produzcan. En este caso, las autoridades competentes deberán presentar los incidentes registrados, como documentos, cuando se les solicite.
El EU MDR requisitos específicos en materia de autocertificación. Se trata de un procedimiento complejo, cuyo factor principal son las diferentes clases dentro de los dispositivos de clase I y sus distintos aspectos en cuanto a los requisitos para obtener el marcado CE. Los fabricantes de dispositivos de clase I en condiciones estériles deben tener en cuenta el ámbito de aplicación y los requisitos específicos.
¿Desea comprender en detalle los diversos aspectos de los dispositivos estériles de clase I? ¿Le gustaría hablar sobre ello con un experto acreditado? Reach con us.