Presentaciones programadas para el 24 de septiembre de 2016.
Ahora que se ha implementado la segunda fase del cumplimiento de la normativa UDI para los productos sanitarios de clase III I/LS/LS, muchos fabricantes de productos, especialmente de clase II, se preguntan cuál es la mejor manera de prepararse para la fecha límite de presentación de datos de productos de clase II, fijada para el 24 de septiembre de 2016. Para ayudarles, en Freyr hemos identificado algunos de los requisitos previos que deben tener en cuenta para que los productos de clase II cumplan con la normativa UDI FDA.
La nueva normativa exige que todos los dispositivos médicos de clase II se etiqueten y empaqueten con un identificador único de dispositivo (UDI) y se introduzcan en la Base de datos global de identificación única de dispositivos (GUDID) FDA. Dada la volatilidad de los requisitos de cumplimiento, junto con los plazos de presentación más cortos, el reto para los fabricantes de dispositivos es conocer a fondo los procesos de cumplimiento. Al mismo tiempo, deben asegurarse de que no se omita ninguno de los atributos clave del dispositivo al recopilar los datos dispersos de los dispositivos en diferentes sistemas y conciliarlos en hojas de cálculo para crear informes de cumplimiento.
Con el fin de ayudar a los fabricantes de dispositivos a navegar fácilmente por este proceso de cumplimiento complejo y urgente, sin cometer errores, Freyr recopilado los siguientes requisitos previos que deben cumplirse.
Determinar la fecha de cumplimiento de la UDI: desde que FDA su norma definitiva, algunas de las fechas de cumplimiento de los dispositivos se han modificado y ampliado. Para planificar meticulosamente con antelación las estrategias y los procesos de cumplimiento y evitar modificaciones apresuradas de última hora, los etiquetadores deberán determinar la fecha de cumplimiento exacta.
Dispositivos de clase II Fecha de cumplimiento Requisitos de conformidad 24 sep 2016Los productos de la clase III que deban etiquetarse con un UDI deberán llevar un UDI como marca permanente en el propio producto si se trata de un producto destinado a ser utilizado más de una vez y destinado a ser reprocesado antes de cada uso. Las etiquetas y envases de los productos sanitarios de la clase II deben llevar un UDI Las fechas de las etiquetas de estos dispositivos deben tener el formato requerido El software autónomo de clase II debe proporcionar su UDI tal y como se requiere Los datos de los productos de la clase II que deben etiquetarse con un UDI deben enviarse a la base de datos GUDID. Para la mayoría de los productos, la fecha de conformidad para el marcado directo es diferente a la de los otros requisitos. Basándose en la categoría de su producto, ya sea destinado a ser reutilizado o destinado a ser reprocesado, determine la fecha de cumplimiento de la UDI de marcado directo como se muestra aquí:
Fechas de cumplimiento del marcado directo Categoría de producto - Reutilizado y reprocesado Sep 24 2015 Dispositivos de mantenimiento y soporte vital, independientemente de su clase 24 sep 2016 Dispositivos de clase III y dispositivos autorizados en virtud de la Ley de Servicios de Salud Pública 24 sep 2018 Dispositivos de clase II Sep 24 2020 Dispositivos de clase I y dispositivos no clasificados Evaluar la necesidad del marcado directo del número UDI: Todos los productos sanitarios que se utilicen más de una vez o que deban reprocesarse antes de cada uso deben llevar un marcado directo del UDI. La excepción son los productos implantables, que no requieren marcado directo según la norma UDI. Los productos que son de un solo uso, aunque se reprocesen, tampoco están obligados a llevar un UDI permanente - 21 CFR 801.45(d)(3). Por tanto, evalúe la necesidad del marcado directo en función de la categoría de productos sanitarios que fabrique.
- Plan de cumplimiento exhaustivo: Revise los FDA de FDA que deben cumplir sus productos específicos. Realice un análisis exhaustivo de las deficiencias para detectar carencias relacionadas con los datos o la tecnología que le permitan hacer frente a algunos de los principales retos que plantea el cumplimiento de los estrictos FDA . Algunos de los retos podrían ser la obtención de la información DI o PI y el manejo de grandes volúmenes de datos no estructurados procedentes de fuentes dispares, etc. En lugar de quemarse las pestañas para conciliar todos Dispositivos Médicos en el último momento, planifique con antelación el cumplimiento integral mediante sistemas y herramientas validados que apoyen la integración, la calidad y la gestión de los datos.
![]()
Obtener el número DI y la afiliación a la Agencia: El UDI se compone del identificador del dispositivo (DI, número único basado en la versión o el modelo del dispositivo) y el identificador del producto (PI, que incluye el número de lote, el número de serie o la fecha de caducidad). La parte DI de la UDI servirá como clave principal para buscar información sobre el dispositivo en la GUDID. Para asignar el DI, la FDA acreditado a tres agencias emisoras: GS1, HIBCC e ICCBBA. En este caso, los etiquetadores deben obtener la membresía de una de las agencias para obtener el número DI que debe introducirse en la GUDID FDA.
![]()
Identificador Atributos Organismos emisores UDI DI (Identificador de dispositivo - Datos estáticos)
Se requiere sincronización con GUDIDNúmero único de
Fabricante
Marca del dispositivo
Modelo de dispositivo
GSI
HIBCC
ICCBBAPI (Identificador de producto - Datos dinámicos)
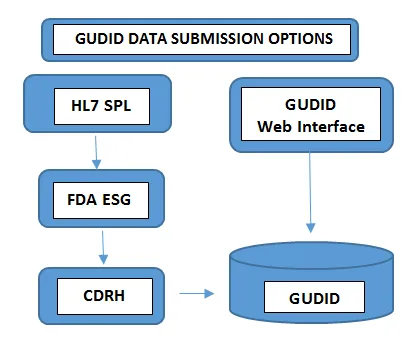
Obligatorio en todos los niveles de envasadoNúmero de lote, Número de serie, Fecha de fabricación Fecha de caducidad, - Presentar los datosLa forma de enviar los datos al GUDID varía en función del volumen de carteras de productos que se gestionen. Los fabricantes de dispositivos con un número mínimo de dispositivos optan por enviar la información UDI manualmente a través de la interfaz web gratuita del GUDID FDA. En este caso, solo se puede enviar un registro DI cada vez a través de una interfaz web segura del GUDID.En el otro caso, los fabricantes con un mayor número de carteras de productos eligen la opción de envío HL7 SPL para recopilar los datos electrónicamente y convertir los datos consolidados al formato SPL antes de enviarlos a la Puerta de Envío Electrónico (ESG) FDA, utilizando el número DUNS. Tenga en cuenta que la cuenta GUDID no es por tipo de envío. La cuenta sirve para identificarle a usted, el etiquetador, y permitir el envío de datos de dispositivos a través de ambas opciones.
![]()
- Configurar una cuenta GUDID: Un etiquetador/fabricante de dispositivos necesita una o más cuentas GUDID en función del número de funciones que se vayan a asignar; por nombrar algunas, coordinador GUDID, usuario de introducción de datos, etc. Sin embargo, para autorizar cada función para la introducción de datos, el fabricante necesita la aprobación de la FDA de crear la cuenta. El proceso de creación de una cuenta GUDID adecuada implica enviar una solicitud por correo electrónico a FDA lo cual el solicitante, usted, recibirá un documento de solicitud de cuenta que deberá rellenar. Una vez que envíe el documento rellenado a la FDA correo electrónico, la agencia revisará el formulario y le enviará un correo electrónico con la información de inicio de sesión de la cuenta GUDID.
La implementación de la UDI es un proceso complejo y que requiere mucho tiempo. Durante el curso, al cumplir con los requisitos de la UDI FDA, Dispositivos Médicos se enfrentan a muchos retos relacionados con la gestión, la integración y el envío de datos. Dado que el plazo para el cumplimiento de los dispositivos de clase II vence dentro de solo un año, Freyr recomienda a las empresas que empiecen a trabajar en ello desde ya.
Para guiar a su organización a través de este complejo proceso de cumplimiento normativo, Freyr lo mejor de ambos mundos: una solución de software UDI totalmente configurable y bajo demanda,Freyr , así como un Centro de Excelencia (CoE) que ofrecelosmejoresservicios UDIde su clase, rentables y personalizables, diseñados en función de sus requisitos únicos y exigentes.