
La gestión de riesgos es una actividad fundamental en todas las fases del Dispositivos Médicos , ya que afecta directamente a la seguridad y el bienestar de los pacientes. Los riesgos son inevitables; sin embargo, pueden reducirse si las empresas son conscientes de los peligros inminentes y siguen procedimientos eficaces de gestión de riesgos.
El Análisis de Modos de Fallo y Efectos (AMFE) es una herramienta de revisión para identificar posibles fallos en un diseño, un proceso de fabricación o montaje, o un producto o servicio en un dispositivo. "Modos de fallo" se refiere a las formas en que puede fallar un dispositivo, que pueden afectar potencialmente a los pacientes. "Análisis de efectos" se refiere al examen de las consecuencias de esos fallos. Se trata de un enfoque paso a paso para garantizar la fiabilidad y la calidad de un dispositivo.
Existen dos tipos de AMFE: FMEA de diseño (DFMEA) y FMEA de proceso (PFMEA). En el contexto de los dispositivos médicos, los fabricantes de dispositivos utilizan DFMEA para evaluar los fallos relativos al diseño y las especificaciones del dispositivo, mientras que PFMEA se utiliza para mejorar el proceso de fabricación.
Aunque el FMEA se ocupa del aspecto del riesgo, no es un sistema de gestión de riesgos. Los requisitos de la gestión de riesgos se definen en la norma ISO 14971:2019, que sirve de marco para que Dispositivos Médicos predigan la probabilidad de los riesgos y sus consecuencias a lo largo del ciclo de vida del producto. La metodología FMEA de evaluación de riesgos no se ajusta a la norma ISO 14971:2019. La FMEA tiene su propia norma aceptada internacionalmente, la IEC 60812:2018, que explica cómo se planifica, realiza, documenta y mantiene el análisis de modos y efectos de fallos. La FMEA y la ISO 14971 difieren entre sí en ciertos aspectos, que son los siguientes:
Uso normal y estado de avería
Según la norma ISO 14971, la gestión de riesgos incluye tanto el uso normal como el uso incorrecto del dispositivo, mientras que el FMEA incluye solo los riesgos asociados al fallo del dispositivo. Un ejemplo sencillo de esto serían los riesgos asociados a la vía intravenosa (IV). La norma ISO 14971 considera el riesgo potencial de infección a pesar de la administración correcta de una IV. Esto puede deberse a diversas razones, como la baja inmunidad del paciente y las infecciones presentes en el entorno hospitalario o clínico. Estos riesgos no se tienen en cuenta en una evaluación FMEA. Aunque Dispositivos Médicos no pueden evitar por completo estos riesgos, pueden concienciar a los usuarios sobre los riesgos residuales asociados al uso del dispositivo.
Evaluación de la gravedad
La norma ISO 14971 considera la gravedad del riesgo en función de los daños a la vida de las personas, mientras que el AMFE la considera en función de los fallos en el funcionamiento del sistema. La gravedad del riesgo puede considerarse baja en el AMFE si se produce una pequeña pérdida de funcionamiento, aunque pueda provocar la pérdida de vidas humanas. La gravedad se considerará alta si el dispositivo se avería.
Por ejemplo, FDA una guía (Clase I) destinada a introducirse en un catéter percutáneo para dirigir el catéter a través de un vaso sanguíneo. La guía en cuestión presenta el riesgo de que se desprenda el recubrimiento. El FMEA clasificó potencialmente este caso como un riesgo de gravedad baja tras la evaluación, pero puede tener graves consecuencias para la salud del paciente.
Procedimiento de evaluación de riesgos / modos de fallo
FMEA e ISO 14971 difieren en la forma de evaluar el riesgo. En el FMEA, el riesgo se evalúa identificando los posibles modos y efectos de los fallos y, a continuación, clasificando la gravedad de los mismos. Se identifica cada una de las causas potenciales y se determina la probabilidad de que se produzcan. El riesgo se evalúa en función del Número de Prioridad de Riesgo (RPN).
Mapeo FMEA
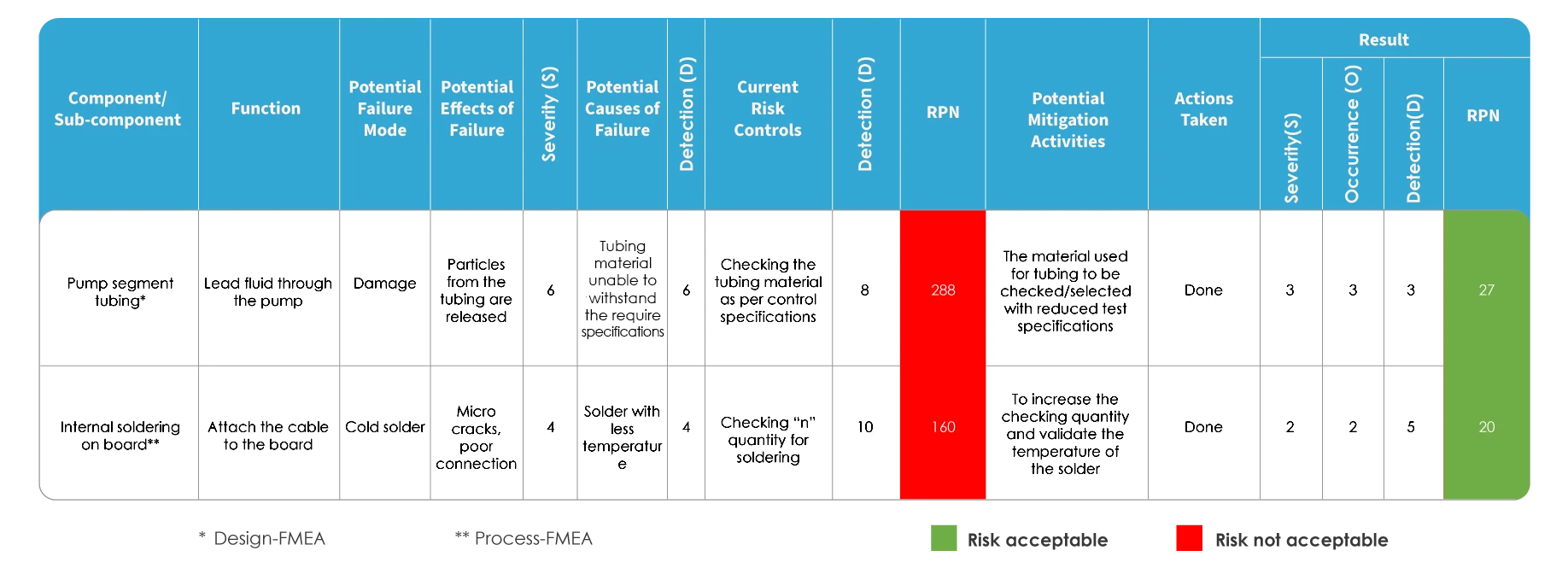
En el caso de la cartografía de la gestión de riesgos según la norma ISO 14971, se utiliza una herramienta de trazabilidad conocida como Matriz de Trazabilidad de Peligros (HTM). Incluye el análisis, la evaluación, el control y la evaluación del riesgo residual.
Matriz de trazabilidad de peligros
| Análisis de riesgos | Riesgo Eval. | Control de riesgos | ||||||||||||
| ID | Peligro | Secuencia o combinación de acontecimientos razonablemente previsible | Peligrosos Situación | Daños | Ocurrencia | Gravedad | ¿Aceptable? | Opciones de control de riesgos y justificación | Control de riesgos Medidas | Riesgo Controlar Verificación | Estado | Riesgo potencial | Gravedad del riesgo | Riesgo residual |
| 1 | Tensión de línea | El usuario utiliza el dispositivo | El usuario/paciente puede exponerse a la tensión de línea mientras está en contacto con el dispositivo | Muerte del usuario/paciente | 5 | 5 | N | La seguridad mediante un cambio en el diseño y las medidas de protección se puede colocar en su lugar. | Diseño conforme a la norma IEC 61010. | Las pruebas eléctricas se realizarán conforme a la norma IEC 61010 | Hecho | 2 | 2 | Y |
![]()
Tras analizar las diferencias entre ambas, se puede concluir que la norma ISO 14971 sigue un enfoque integral de la gestión de riesgos, mientras que el FMEA es más bien una herramienta de fiabilidad. Sin embargo, Dispositivos Médicos tendrían que cumplir con la norma ISO 14971 para satisfacer las expectativas de las autoridades reguladoras en materia de normas de gestión de riesgos.
Para obtener más información sobre el cumplimiento de la norma ISO 14971:2016 y los servicios de consultoría en gestión de riesgos, póngase en contacto con Freyr hoy mismo.









