A lo largo de los años, con los avances del software y la digitalización, se ha producido un cambio radical en el modo en que se administran y suministran los dispositivos médicos. La integración del software con los dispositivos médicos ha aumentado rápidamente y ha impulsado avances increíbles en el suministro de soluciones sanitarias en diversos ámbitos, como el diagnóstico, la prevención de enfermedades y el tratamiento de lesiones o enfermedades.
Sin embargo, el efecto del software en la seguridad y el rendimiento de los dispositivos médicos ha sido dudoso, especialmente cuando el dispositivo en sí mismo es un producto exclusivamente de software. Por lo tanto, las normativas Dispositivos Médicos se revisan constantemente para determinar si el software debe considerarse un Dispositivos Médicos SaMD). Recientemente, el comité consultivo de la European Commission el Grupo Dispositivos Médicos (MDCG), se ha centrado en mejorar la normativa sobre Dispositivos Médicos y ha publicado una guía en la que se describe el enfoque que debe aplicarse para determinar si un software es un Dispositivos Médicos no. ¿Qué es lo que se describe en la guía? Vamos a desvelarlo.
Ámbito de aplicación de las Orientaciones
La guía del MDCG abarca tanto el Dispositivos Médicos como Dispositivos Médicos de diagnóstico in vitro (IVD). Según el documento, un Dispositivos Médicos (MDSW) se define como un software destinado a ser utilizado solo o en combinación, para un fin especificado en la definición deDispositivos Médicosdel Reglamento sobre productos sanitarios 2017/745 (MDR) o en el Reglamento sobre productos sanitarios para diagnóstico in vitro 2017/746 (IVDR). En él se describen los criterios que deben aplicarse para determinar si un software sujeto a revisión es un Dispositivos Médicos no, y se pretende ofrecer aclaraciones y recomendaciones adicionales sobre el MDSW a Dispositivos Médicos y otras partes interesadas.
En primer lugar, las orientaciones establecen los términos más importantes utilizados en el contexto del MDSW, entre los que se incluyen:
Finalidad prevista: el uso al que se destina un producto según los datos facilitados por el fabricante en la etiqueta, en las instrucciones de uso o en los materiales o declaraciones promocionales o de venta, y según lo especificado por el fabricante en la evaluación clínica.
Accesorio: Artículo que, aunque no es en sí mismo un Dispositivos Médicos, está destinado por su fabricante a ser utilizado junto con uno o varios Dispositivos Médicos para permitir específicamente que Dispositivos Médicos se utilicen de acuerdo con su finalidad o finalidades previstas, o para ayudar Dispositivos Médicos de los Dispositivos Médicos de forma específica y directa en lo que respecta a su finalidad o finalidades previstas. Además, el MDCG menciona que el accesorio de software puede impulsar o influir en el uso de un Dispositivos Médicos las instrucciones de uso y demás documentación proporcionada por el fabricante deben contener detalles sobre la forma en que se deben seleccionar el software y los accesorios adecuados.
Software: es un conjunto de instrucciones que procesa datos de entrada y crea datos de salida.
Dispositivos Médicos Determinación de Dispositivos Médicos
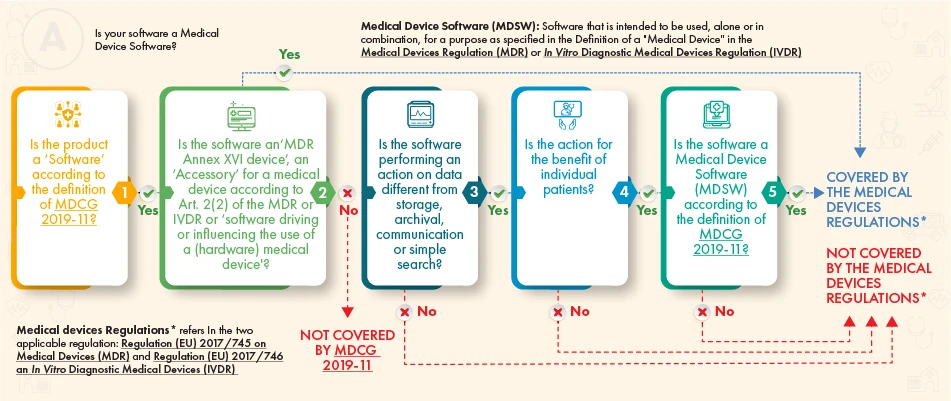
Según el diagrama de flujo orientativo anterior, el software en cuestión debería estar sujeto a regulación si cumple los siguientes criterios:
- La definición de un Dispositivos Médicos, un accesorio del mismo, o que impulsa el funcionamiento de los Dispositivos Médicos, o
- Realiza un procesamiento adicional de los datos (no solo almacenamiento o comunicación) y su acción genera beneficios para los pacientes y cumple con la definición de Dispositivos Médicos de acuerdo con las directrices del MDCG.
Determinación del software de productos sanitarios para diagnóstico in vitro
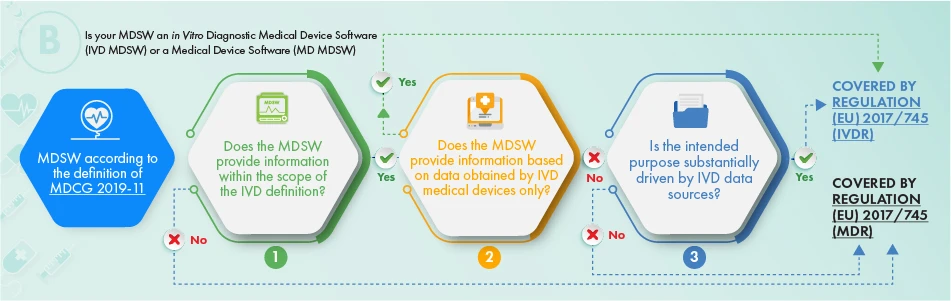
El diagrama de flujo anterior describe el planteamiento que debe aplicarse en relación con los productos destinados al diagnóstico in vitro. Para determinar si el programa informático en cuestión debe estar sujeto a reglamentación, deben tenerse en cuenta los siguientes criterios:
- La definición de un Dispositivos Médicos, un accesorio del mismo, o que impulsa el funcionamiento de los Dispositivos Médicos, o
- Proporciona la información que suelen proporcionar los dispositivos médicos de diagnóstico in vitro y solo la información recopilada de un Dispositivos Médicos de diagnóstico in vitro, o
- La finalidad prevista del programa informático está relacionada con asuntos de IVDR
Según las directrices del MDCG, el tipo de interconexión entre el Dispositivos Médicos y el dispositivo no afecta a la calificación del software como dispositivo en virtud del MDR y el IVDR. El Dispositivos Médicos puede existir como producto independiente o incorporarse a un dispositivo de hardware, y aclara los siguientes requisitos reglamentarios:
- Teniendo en cuenta su calificación y clasificación, un producto Dispositivos Médicos independiente Dispositivos Médicos debe someterse a todos los procedimientos reglamentarios de conformidad con la legislación aplicable.
- Dispositivos Médicos que sea un componente o parte integrante de un Dispositivos Médicos de hardware Dispositivos Médicos comercializarse mediante el procedimiento simplificado. No se sometería a una revisión por separado, sino durante la evaluación general del Dispositivos Médicos de hardware.
En resumen, las directrices del MDCG abarcan los aspectos fundamentales relacionados con la clasificación del Dispositivos Médicos y la determinación de los requisitos reglamentarios que deben aplicarse. Dispositivos Médicos , los desarrolladores de software y otras partes deben seguir y aplicar las recomendaciones del MDCG para garantizar el cumplimiento. Para obtener más información sobre cómo determinar si su software es un Dispositivos Médicos, consulte a un experto en normativa. Manténgase informado. Mantenga el cumplimiento.









