El etiquetado es una parte integral de la comercialización de los productos sanitarios. La etiqueta es una pieza de información adherida al producto y/o al embalaje en un formato legible para las personas. El objetivo principal del etiquetado es proporcionar información de seguridad a los usuarios, que pueden ser profesionales sanitarios, consumidores o cualquier otra persona relevante.
Todas las autoridades reguladoras mundiales tienen ciertos requisitos de etiquetado. Del mismo modo, la UE ha detallado los requisitos de etiquetado en el capítulo III del anexo I del Reglamento de la UE sobre productos sanitarios (EU MDR) 2017/745. Lo más importante es incluir todos los símbolos que cubren la información requerida en el etiquetado del dispositivo y en los documentos (folletos, manuales, instrucciones de uso, etc.) que lo acompañan.
Algunas de las consideraciones críticas en materia de etiquetado que deben tenerse en cuenta al cumplir con el Reglamento EU MDR son:
1. Simbología Dispositivos Médicos
Todos los fabricantes deben incorporar el Dispositivos Médicos , que indica que el producto suministrado al mercado de la UE es un Dispositivos Médicos. Es obligatorio colocar este símbolo en el dispositivo y en todos los niveles de embalaje. Además, la etiqueta debe mostrar el nombre comercial y el nombre original del dispositivo.
2. Dispositivos especiales
En caso de que el producto sea un dispositivo especial o personalizado, deberá mencionarse en el etiquetado la situación del mismo. Por ejemplo, si la finalidad del producto es únicamente la investigación clínica, la etiqueta debe indicarlo explícitamente.
Para los productos con materiales absorbentes o que puedan dispersarse localmente en el cuerpo humano, el etiquetado debe mencionar la composición del material y detalles cuantitativos sobre los componentes clave.
Incluso se requiere un etiquetado explícito en el caso de los productos de un solo uso y los productos estériles. En el caso de los productos reprocesados, el etiquetado debe mencionar el número de veces que pueden reprocesarse, el número de veces que se han reprocesado hasta ahora y el método de esterilización utilizado.
3. Presencia de sustancias tóxicas
La declaración de la presencia de sustancias CMR (carcinógenas, mutágenas, tóxicas para la reproducción) y sustancias alteradoras endocrinas es obligatoria en las etiquetas si la concentración es superior al 0,1% p/p. La lista de dichas sustancias debe figurar en el dispositivo y/o en el envase.
Además, debe colocarse en los productos una etiqueta sobre la presencia de derivados sanguíneos y tisulares (incluso cuando estén contenidos en la sustancia medicinal del producto combinado).
4. Normas armonizadas
El Reglamento EU MDR reconoce y acepta la norma ISO 15223-1: 2021. El documento determina los símbolos que deben utilizarse en el etiquetado de los productos sanitarios y sus envases. El capítulo 3 (23.1, h) del anexo I EU MDR que se pueden utilizar símbolos reconocidos internacionalmente y, en el caso de las regiones en las que estos símbolos no sean reconocidos, se requiere que se proporcione una descripción de los mismos en un documento junto con el producto.
5. UDI
Los artículos 27, 28, 29 y el anexo VI (A, B, C) detallan las normas y reglamentos para la UDI. Ahora se exige que la etiqueta contenga un soporte de UDI [identificación automatizada para la captura de datos (AIDC) y representación de interpretación legible por humanos (HRI) de la UDI] en el dispositivo y también en los niveles de embalaje superiores. El embalaje superior del dispositivo (excluidos los paquetes de envío) tendrá su propio soporte de UDI.
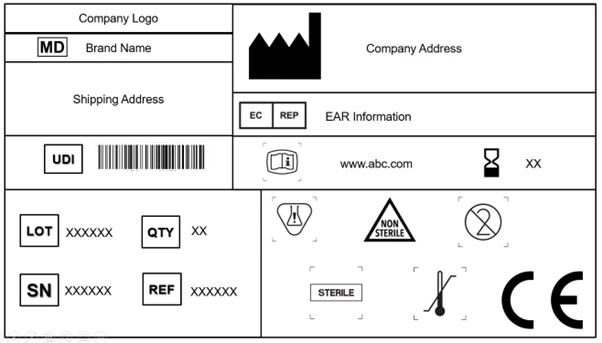
6. Información electrónica para uso (eIFU)
La dirección web (URL) en forma de instrucciones de uso electrónicas también puede incluirse en el Dispositivos Médicos junto con las instrucciones de uso en papel. Las instrucciones de uso electrónicas pueden utilizarse en el caso de dispositivos médicos implantables, implantables activos, fijos y software (también destinados a personas sin conocimientos técnicos).
7. Información de los Operadores Económicos (OE)
La etiqueta suele contener la información del fabricante. Sin embargo, en el caso de fabricantes extranjeros, la información del representante autorizado debe figurar en las etiquetas comerciales.
8. Advertencias y precauciones
Las advertencias y precauciones deben mencionarse en la etiqueta del aparato. La información sobre este aspecto puede ser mínima, y los detalles de la misma pueden facilitarse en la IFU.
Los fabricantes también deben cumplir los requisitos de etiquetado específicos de cada país. El requisito lingüístico depende del Estado miembro de la UE. Puede tener un gran impacto en el etiquetado, las instrucciones de uso y el embalaje del producto en términos de tiempo y costes.
Estos requisitos adicionales pueden aumentar aún más la carga del fabricante con la complejidad del proceso de etiquetado existente. El fallo en el mismo puede llegar a ser muy costoso, implicando la retirada de productos y los subsiguientes pasos para la Acción Correctiva y Preventiva (CAPA).
¿Necesita ayuda con el etiquetado según el Reglamento sobre productos sanitarios ( EU MDR? Freyr servicios integrales de etiquetado de productos sanitarios. No dude en ponerse en contacto con nuestros expertos en normativa en: sales@freyrsolutions.com.










