A nivel mundial, las agencias sanitarias exigen a los fabricantes extranjeros de productos sanitarios y de diagnóstico in vitro que designen a un representante local. En Japón, en virtud de la Ley revisada de Productos Farmacéuticos y Dispositivos Médicos PMD), el sistema de cuidador en el país (ICC) fue sustituido por el sistema de titular de la autorización de comercialización (MAH). En virtud de este sistema, las empresas deben obtener una licencia MAH para obtener la aprobación del producto y comercializarlo en Japón.
El titular de la autorización de comercialización (MAH) debe ser una entidad local ubicada en Japón. Los fabricantes nacionales pueden obtener directamente la licencia MAH, mientras que el fabricante extranjero deberá identificar una entidad local para cumplir con este requisito MAH.
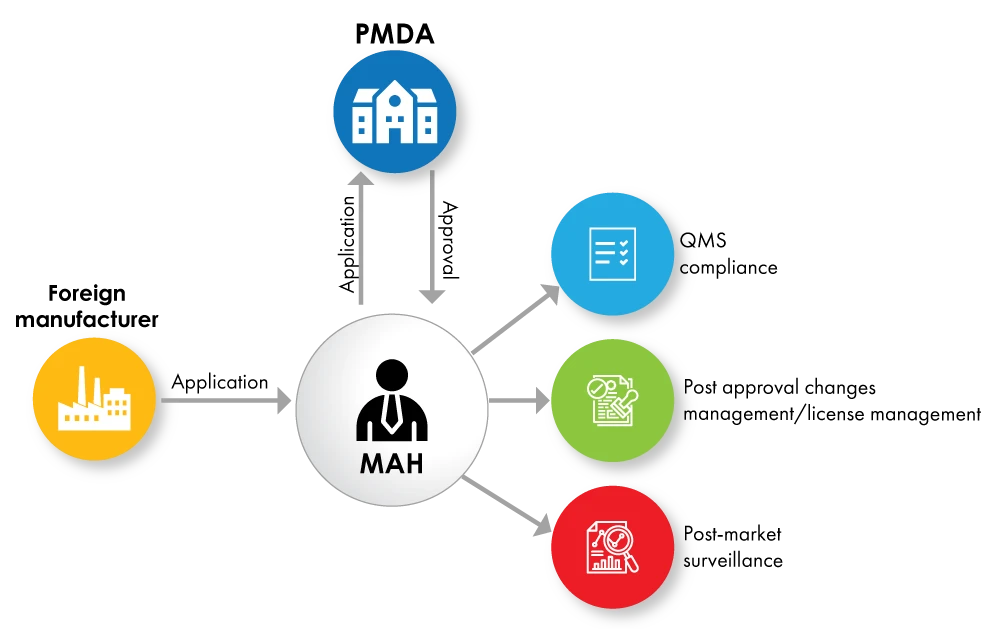
Fig. nº 1: Diagrama de flujo del registro de dispositivos con MAH como titular de licencia
Si los fabricantes extranjeros no desean ceder la plena propiedad del producto al titular de la autorización de comercialización, pueden designar a un titular de la autorización de comercialización designado (DMAH). El DMAH presenta la solicitud en nombre del fabricante extranjero, y se concede la aprobación al fabricante extranjero para el producto.
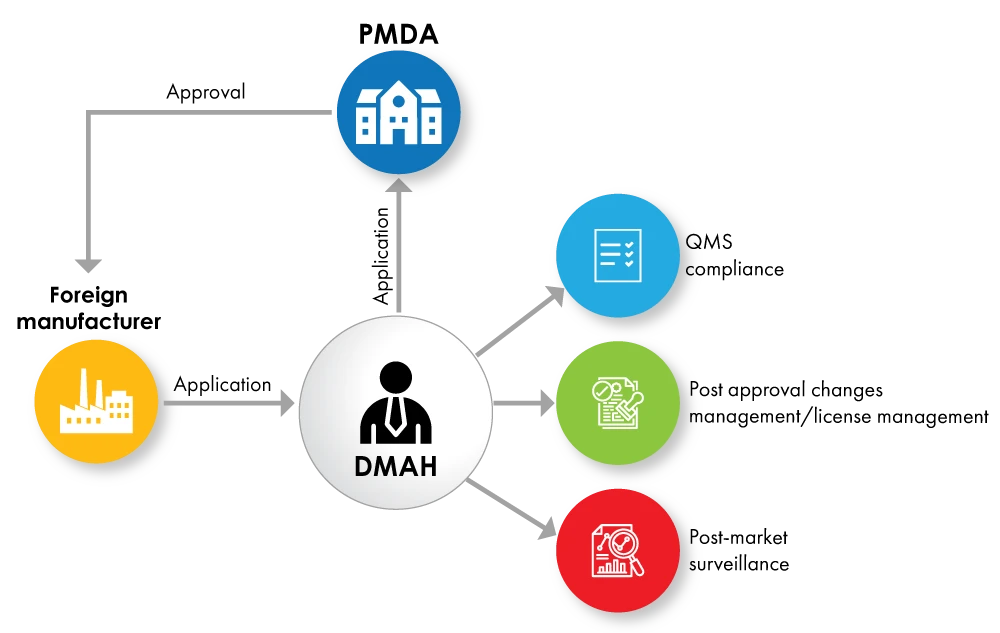
Fig. nº 2: Diagrama de flujo del registro de dispositivos con DMAH como titular de licencia
Hay tres (03) opciones posibles mediante las cuales el fabricante extranjero puede cumplir con el requisito de MAH PMDA. Los fabricantes extranjeros deben evaluar minuciosamente las tres (03) posibilidades. Estas incluyen:
Establecer una filial en Japón
Los fabricantes extranjeros pueden establecer una oficina local en Japón y actuar como titulares de la autorización de comercialización para lanzar sus productos en Japón. Esto permite al fabricante extranjero tener la plena propiedad y visibilidad de sus productos en Japón. Puede que esta no sea la opción preferida para los fabricantes de pequeño tamaño, ya que el coste asociado al establecimiento de una filial en Japón y al mantenimiento de los requisitos de calidad del Ministerio de Salud, Trabajo y Bienestar ( MHLW) es bastante elevado.
Distribuidor como MAH
Es una forma rentable para los fabricantes extranjeros que no tienen una oficina local en Japón. Los importadores o distribuidores pueden ser designados como MAH o DMAH. Teniendo en cuenta los ingresos generados por las ventas de dispositivos, los importadores y distribuidores no suelen cobrar tarifas adicionales por actuar como MAH o DMAH. Sin embargo, los fabricantes se enfrentan a dificultades para penetrar en el mercado, ya que es posible que el distribuidor que actúa como MAH no esté dispuesto a expedir un certificado de no objeción (NoC) a otros distribuidores. En ocasiones, los distribuidores no cooperan con el fabricante extranjero a la hora de cambiar el MAH y transferir la licencia del dispositivo al nuevo MAH/DMAH identificado.
Alianza con terceros
Los fabricantes extranjeros pueden designar a un proveedor de servicios externo independiente como su MAH/DMAH. La confidencialidad de los dispositivos está bien protegida y el fabricante extranjero controla la propiedad legal del producto. Los fabricantes pueden aplicar y hacer realidad sus planes de expansión en el mercado.
Responsabilidades del titular de la autorización de comercialización
Un MAH/DMAH actúa como representante en nombre del fabricante extranjero y colabora en la aprobación de productos en Japón. Las principales responsabilidades de un MAH/DMAH son:
- Aprobación End-to-end
- Garantizar la entrada en el mercado japonés de dispositivos seguros y de calidad gestionando adecuadamente la fabricación y el control de calidad de los productos.
- Ser responsable de la entrega del dispositivo a la parte que posee una licencia Dispositivos Médicos
- Gestión de Post-Market Surveillance (PMS)
Dado que el MAH/DMAH debe cumplir todas las medidas de seguridad, Quality Management System (QMS) y las Buenas Prácticas de Vigilancia (BPV) en nombre del fabricante extranjero, es extremadamente importante elegir el MAH/DMAH adecuado. Por lo tanto, los fabricantes extranjeros deben evaluar minuciosamente todas las opciones antes de optar por el mejor modelo de MAH posible. Entre ellas se incluyen la realización de un análisis de viabilidad, la determinación del RoI, la relación con los importadores y distribuidores, el presupuesto disponible, el tamaño de la cartera, los beneficios por la venta de dispositivos, los plazos para el lanzamiento de los dispositivos, etc. Los fabricantes deben elegir meticulosamente si conceder la propiedad del dispositivo al MAH o nombrar a un DMAH y conservar la propiedad.
Para obtener más información sobre los requisitos MAH/DMAH en Japón, reach con un experto en normativa de Freyr. Manténgase informado. Cumpla con la normativa.









