
Dispositivos Médicos (MDR) de la Unión Europea (UE) lleva ya un tiempo siendo noticia. El MDR ha sustituido a la Dispositivos Médicos (MDD) y a la Directiva sobre productos sanitarios implantables activos (AIMDD). Inicialmente, se preveía que la transición estuviera completamente efectiva en mayo de 2020; sin embargo, debido a la aparición de la pandemia de COVID-19, la implementación se pospuso hasta el 26 de mayo de 2021. En este plazo, para el 26 de mayo de 2024, todos los certificados MDD quedarán sin efecto y los fabricantes de dispositivos deberán cumplir con el EU MDR. Además, los dispositivos MDD comercializados legalmente de conformidad con las Directivas 90/385/CEE y 93/42/CEE antes del 26 de mayo de 2020, y los dispositivos comercializados a partir del 26 de mayo de 2020 en virtud de un certificado, seguirán estando disponibles en el mercado hasta el 27 de mayo de 2025. A continuación se describen los plazos:
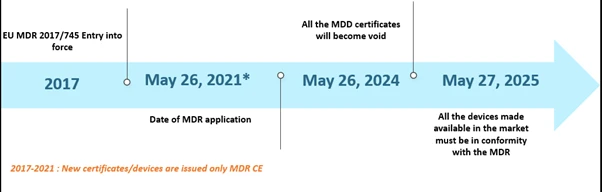
Cronología de escenarios EU MDR de EU MDR
Sin embargo,la capacidad limitada de los organismos notificados (ON) y la falta de preparación de los fabricantes plantearon algunos retos en la aplicación del MDR según el calendario establecido. En octubre de 2022, hay un total de treinta y ocho (38) organismos notificados (ON), que han recibido alrededor de 8120 solicitudes de EU MDR , de las cuales se han expedido 1990 certificados. Según sus estimaciones con el calendario inicial, solo se podrían tramitar 7000 certificados, lo que provocó una nueva ampliación del plazo. Además, otra de las posibles razones de la ampliación fue garantizar la disponibilidad continua de productos sanitarios seguros cuyos certificados ya han caducado o caducarán antes del 26 de mayo de 2024. A continuación se describe la situación actual del calendario ampliado.
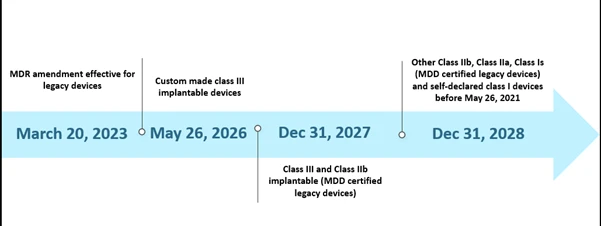
Cronología de escenarios EU MDR de EU MDR
La nueva ampliación es aplicable a los productos heredados que cumplan el artículo 120 (3e) con una MDD CE o excepción válida a 20 de marzo de 2023, y permanecerán en el mercado junto con los productos MDR con marcado CE. Para el 26 de mayo de 2024, los fabricantes de productos heredados deberán tener implantado un SGC y haber presentado una solicitud de evaluación de la conformidad ante un organismo nacional designado por la MDR, y para el 26 de septiembre de 2024, los fabricantes de productos heredados deberán tener un acuerdo con un organismo nacional designado por la MDR.
Veamos ahora el impacto que podrían tener los fabricantes con esta ampliación.
Oportunidades que tienen los fabricantes con esta ampliación:
- Ampliación del acceso al mercado para los fabricantes de dispositivos certificados por la MDD/AIMDD que ya han adoptado las iniciativas de cumplimiento del MDR.
- Los fabricantes con certificación MDR cuyos certificados MDD/AIMDD CE no hayan sido revocados podrán comercializar dispositivos heredados hasta el final del período de transición, además de sus dispositivos conformes con MDR.
- Los fabricantes que cuenten con una excepción nacional a fecha de 20 de marzo de 2023 podrán beneficiarse del período transitorio.
- El periodo de prórroga da más tiempo para comprender mejor las normas y reglamentos, lo que ayuda a agilizar el proceso y lograr el cumplimiento del MDR.
Retos que podrían plantearse a los fabricantes con esta ampliación:
- No hay ningún beneficio comercial para los fabricantes de dispositivos antiguos que no quisieron cumplir con el MDR.
- La prórroga del MDR puede hacer que los procesos de certificación se alarguen y retrasen el lanzamiento de productos, lo que es consecuencia directa del retraso de las revisiones por parte de los organismos nacionales.
¿Qué medidas deben tomar los fabricantes?
- Es imprescindible que los fabricantes determinen la clase de riesgo MDR de sus Dispositivos Médicos identificar rápidamente el calendario de transición adecuado según las normas MDR modificadas.
- Para garantizar el cumplimiento de la normativa MDR, es fundamental identificar e iniciar la comunicación con los organismos notificados designados por el MDR que posean la competencia específica necesaria para la clasificación de sus Dispositivos Médicos.
- Es fundamental realizar una evaluación exhaustiva de las deficiencias de sus Dispositivos Médicos según la MDD/AIMDD, identificar y abordar cualquier incumplimiento de la normativa MDR y garantizar el cumplimiento oportuno.
Es esencial que los fabricantes tomen medidas inmediatas para garantizar el cumplimiento del MDR. La ampliación del plazo ofrece algunas oportunidades a los fabricantes para lograr el cumplimiento del MDR, pero también plantea retos, como el retraso en los procesos de certificación y el coste del cumplimiento. Para superar estos retos y aprovechar las oportunidades, deje que nuestro equipo de profesionales le ayude en el proceso de cumplimiento del MDR y le garantice el éxito en este difícil entorno normativo. Concierte una cita con us para obtener más información sobre cómo podemos ayudarle a cumplir con el MDR y mantenerse a la vanguardia. Manténgase informado. Mantenga el cumplimiento.









