
¿Qué papel desempeña la ciberseguridad en los productos sanitarios?
El proceso de autorización 510(k)es una vía reglamentaria utilizada por la Administración de Alimentos y MedicamentosUS FDA) para evaluar y autorizar la distribución comercial de dispositivos médicos. El proceso tiene por objeto garantizar que los dispositivos médicos sean seguros y eficaces para su uso por parte de los pacientes.FDA US FDA la ciberseguridad como «el proceso de prevenir el acceso no autorizado, la modificación, el uso indebido o la denegación de uso, o el uso no autorizado de la información que se almacena, se accede o se transfiere desde un Dispositivos Médicos un destinatario externo».
Los dispositivos médicos se conectan cada vez más a las redes y, por tanto, son vulnerables a amenazas de ciberseguridad como la piratería informática, la violación de datos y los ataques de malware. Abordar la ciberseguridad en la fase de diseño y desarrollo es fundamental para garantizar que los dispositivos médicos dispongan de los controles de seguridad adecuados. Las amenazas y vulnerabilidades no pueden eliminarse, y reducir los riesgos de ciberseguridad es especialmente difícil. Si la ciberseguridad no se mantiene adecuadamente, podría comprometer la funcionalidad de los dispositivos, provocar la pérdida de datos personales o médicos y la posibilidad de que las amenazas a la seguridad se propaguen a otras redes o dispositivos interconectados.
Incidentes causados por una ciberseguridad comprometida
Los incidentes de ciberseguridad han provocado que los dispositivos médicos y las redes hospitalarias dejen de funcionar, lo que ha dado lugar a la interrupción de la prestación de asistencia sanitaria en todos los centros médicos de US. Estos ciberataques y vulnerabilidades también pueden causar daños a los pacientes debido a riesgos clínicos, como retrasos en el diagnóstico o el tratamiento.
A continuación se enumeran los principales incidentes ocurridos en el sector sanitario que subrayan la importancia de la ciberseguridad para la seguridad de los pacientes.
- En 2017, el ataque de ransomware WannaCry afectó a sistemas hospitalarios y dispositivos médicos de todo el mundo.
- En 2020, un ataque de ransomware a un hospital alemán puso de manifiesto los posibles efectos de ochenta y tres (83) retrasos en la atención al paciente, ya que el ataque obligó a desviar a los pacientes a otro hospital.
Consideraciones clave en materia de ciberseguridad para la autorización 510(k)
A continuación se exponen los principios generales de ciberseguridad para Dispositivos Médicos , según las directricesFDA deFDA US específicas para las solicitudes previas a la comercialización.
- Reglamento sobre sistemas de calidad (QSR):Los fabricantes deben abordar las cuestiones de ciberseguridad en la fase de diseño y desarrollo de los Dispositivos Médicos, ya que esto puede dar lugar a una mitigación más sólida y eficaz de los riesgos para los pacientes. Los fabricantes deben establecer requisitos de diseño relacionados con la ciberseguridad para sus dispositivos y un enfoque de gestión y vulnerabilidad de la ciberseguridad como parte de la validación del software y el análisis de riesgos que exige el artículo 21 CFR 820.30(g).
- Seguridad del diseño:Los fabricantes de dispositivos deben garantizar que sus productos se diseñen teniendo en cuenta la seguridad del dispositivo.FDA US FDA la idoneidad de la seguridad, basándose en la capacidad del dispositivo para proporcionar e implementar objetivos de seguridad tales como autenticidad, autorización, disponibilidad, confidencialidad y seguridad, y capacidad de actualización oportuna en toda la arquitectura del sistema.
- Transparencia: La falta de información sobre ciberseguridad en el dispositivo, como la información necesaria para integrar el dispositivo en el entorno de uso, así como la información que necesitan los usuarios para mantener la ciberseguridad durante el ciclo de vida del dispositivo, puede afectar a su seguridad y eficacia. Para hacer frente a estas preocupaciones, es importante que los usuarios del producto tengan acceso a la información relativa a los controles de ciberseguridad, los riesgos potenciales y otra información pertinente.
- Documentación de presentación: Se espera que el diseño y la documentación de ciberseguridad de los dispositivos se adapten al riesgo de ciberseguridad de un dispositivo. Los fabricantes deben tener en cuenta el sistema más amplio en el que puede utilizarse un dispositivo.
Figura 1: Retos y soluciones comunes en materia de ciberseguridad 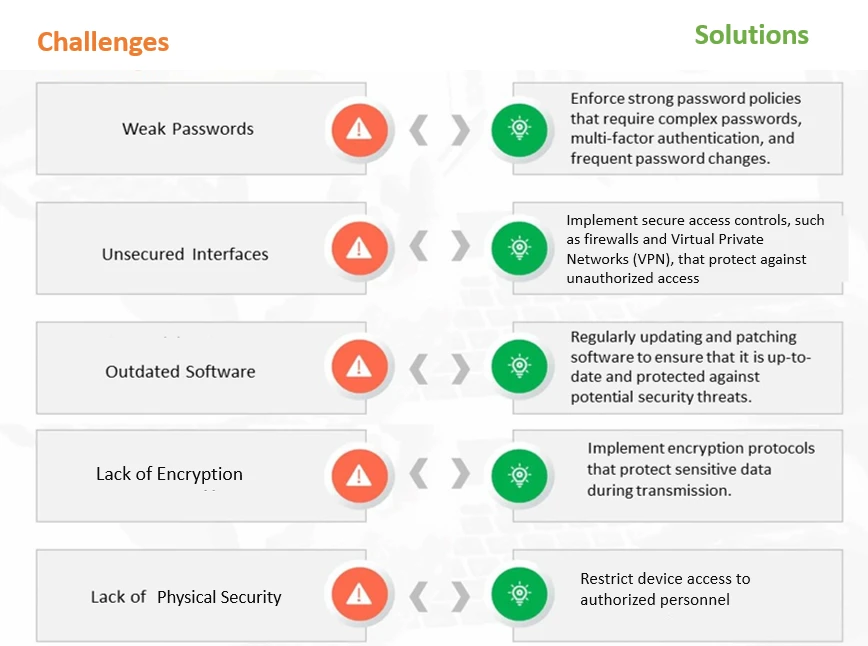
Conclusión
En resumen, la ciberseguridad en los dispositivos médicos es fundamental para garantizar la seguridad de los pacientes y prevenir incidentes que puedan interrumpir la prestación de asistencia sanitaria. Las normasFDA US hacen hincapié en la necesidad de que los fabricantes aborden las cuestiones de ciberseguridad durante el diseño y el desarrollo de los dispositivos médicos y proporcionen información transparente sobre los controles de ciberseguridad. El QSR, la seguridad del diseño, la transparencia y la documentación presentada son aspectos clave para la autorización 510(k). También es importante abordar los retos comunes de ciberseguridad, como las vulnerabilidades de los componentes de terceros y los ataques de ransomware, e implementar soluciones como un análisis de riesgos sólido y actualizaciones periódicas del software.
Para experimentar un proceso de autorización 510(k) sin complicaciones y conforme a las normas, póngase en contacto con nuestros expertos en Reglamentación. Manténgase informado Cumpla la normativa.









