
Con la visión de la trazabilidad global de los dispositivos, el Ministerio de Seguridad Alimentaria y Farmacéutica (MFDS) de Corea del Sur ha sugerido/impuesto un nuevo requisito normativo para incorporar el sistema de identificación única de dispositivos (UDI) en los dispositivos médicos. Dispositivos Médicos y el UDI son procedimientos integrados, y el UDI es un requisito previo para establecer dispositivos médicos en el mercado coreano. Para garantizar la seguridad de los pacientes, el MFDS introdujo en 2016 el Sistema Integrado Dispositivos Médicos (IMDIS), una plataforma para regular la trazabilidad de los dispositivos médicos en Corea del Sur.
De acuerdo con el artículo 2 de Dispositivos Médicos que especifica Dispositivos Médicos UDI Dispositivos Médicos , un sistema UDI incluye los números y códigos de barras indicados en el envase y el embalaje, etc., de los dispositivos médicos en un sistema estandarizado para identificarlos y gestionarlos de forma exhaustiva y eficaz. La MFDS espera que los fabricantes registren la información en la plataforma IMDIS. IMDIS se utiliza para vincular electrónicamente el sistema de información relacionado con los dispositivos médicos.

Fuente: Easy Dispositivos Médicos
UDI consiste en un código de barras legible por máquina que incluye:
- Identificador del dispositivo: una combinación de cifras o alfabetos generada de forma exclusiva para cada producto en el UDI.
- Identificador del producto: combinación de cifras o letras generada por la unidad de producción en el UDI. Incluye el número de fabricación (lote, número de serie), la fecha de producción y la información sobre la versión del producto.
Plazos para incorporar los requisitos UDI en el envasado de productos sanitarios:
Como parte de la revisión Dispositivos Médicos de 2016, se introdujo el IMDIS para comprender y llevar a cabo un seguimiento sistemático de los dispositivos. Tras la exitosa implementación de la plataforma IMDIS, se llevó a cabo la incorporación de la UDI en el embalaje de forma gradual, haciendo que la UDI fuera obligatoria, tal y como se muestra en la siguiente imagen.
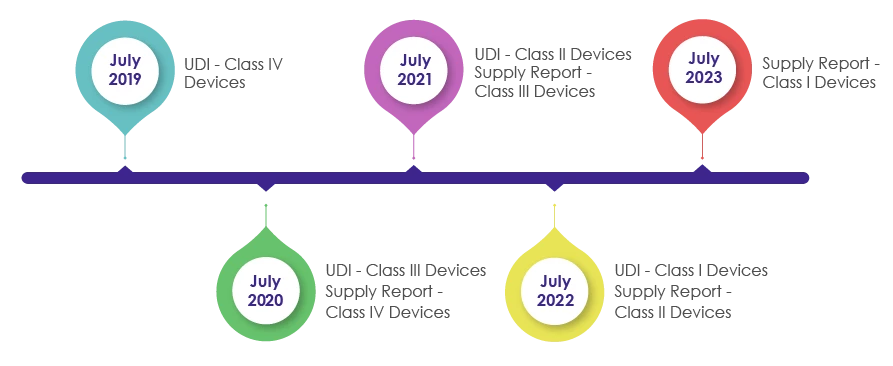
La MFDS exige a Dispositivos Médicos , vendedores y proveedores Dispositivos Médicos que registren los datos de los dispositivos suministrados y proporcionen la información sobre el suministro (que incluye el proveedor, el número de lote, la unidad de embalaje, la cantidad, la fecha y el precio unitario de venta) en el informe de suministro de la UDI.
Proceso de generación de un UDI:
Dispositivos Médicos o importadores Dispositivos Médicos deberán asignar un UDI a sus dispositivos por nombre de modelo y unidad de embalaje, de conformidad con el artículo 3, apartado 2, antes de enviar los dispositivos médicos autorizados, certificados o notificados. Cuando el UDI se marque como código de barras, se utilizará el sistema internacional GS1. Para el UDI-DI, se utilizará un código GTIN (Global Trade Item Number), mientras que para el UDI-PI se utilizarán identificadores de aplicación GS1 (AI).
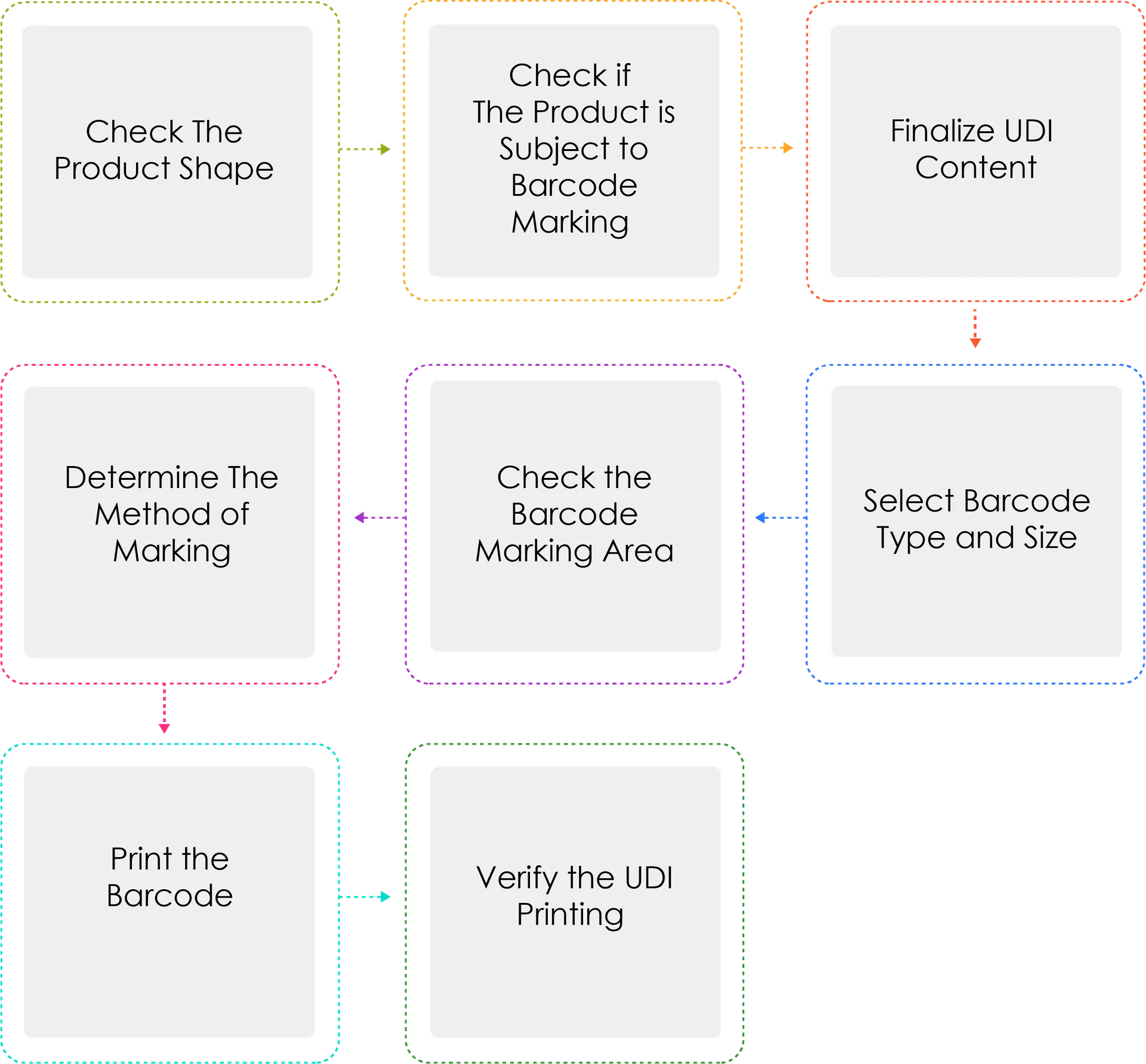
¿Por qué Determine el método de marcado escrito tres veces?
Con la aplicación de los requisitos de conformidad UDI, el MFDS puede agilizar las actividades previas a la comercialización (es decir, la conformidad del SGC, la evaluación del ensayo clínico y la aprobación general), así como las actividades posteriores a la comercialización (es decir, notificación de EA, retiradas) de los dispositivos. El intento consciente del MFDS de rastrear y supervisar los productos garantizará la seguridad y eficacia de los productos en el mercado surcoreano.
Para obtener más información sobre el cumplimiento de la normativa UDI y el proceso Dispositivos Médicos en Corea del Sur, reach con Freyr.









