
510(k) es una presentación previa a la comercialización que se realiza ante la FDA demostrar que el dispositivo que se va a comercializar es tan seguro y eficaz, es decir, sustancialmente equivalente a un dispositivo comercializado legalmente (predicado). Los dispositivos con riesgo moderado deben presentar una notificación 510(k), lo que incluye una minoría de dispositivos de clase I y III y una mayoría de dispositivos de clase II.
Hay tres (03) tipos de programas 510(k): tradicional, abreviado y especial. La vía de seguridad y rendimiento se introdujo en 2019 y se basó en el programa abreviado. El programa eSTAR, introducido en 2020, permite presentar Dispositivos Médicos completa Dispositivos Médicos a través de un formulario PDF interactivo.
¿Quién necesita una certificación 510(k)?
510(k) es, esencialmente, el nombre del proceso o vía que US Dispositivos Médicos que desean comercializar sus productos de riesgo moderado a alto en los US para demostrar que el producto que se va a comercializar es tan seguro y eficaz como un dispositivo comercializado legalmente.
A continuación se detalla el proceso paso a paso para obtener una autorización 510(k).
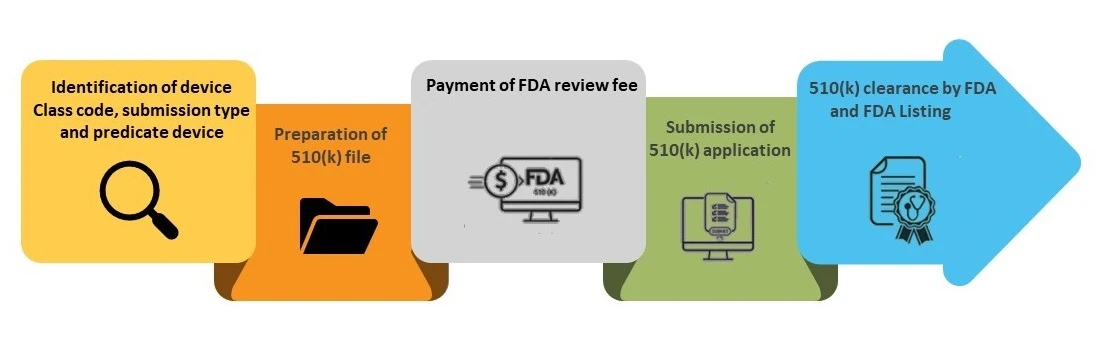
Paso 1- Identificación del código de clase de producto, tipo de presentación y producto de referencia
- Identificar el código del producto y el número de regulación : para determinar los requisitos de la prueba 510(k), primero es necesario identificar el código del producto y el número de regulación. Se puede iniciar una búsqueda en la FDA para encontrar el número de regulación de 7 dígitos cuya identificación coincida con el uso previsto del dispositivo en cuestión.
- El código FDA consta de tres (03) letras. La información relativa a la clasificación del producto, la descripción de la normativa y los requisitos de buenas prácticas de fabricación (GMP) se puede localizar utilizando este código.
- Selección del tipo de presentación: el solicitante puede elegir uno de los tres (03) tipos de presentación mencionados anteriormente. El 510(k) tradicional es para las primeras presentaciones, el 510(k) especial es para Dispositivos Médicos que desean presentar cambios en un dispositivo existente y el 510(k) abreviado se puede elegir cuando el dispositivo cumple con las normas consensuadas voluntarias establecidas. En el caso de un 510(k) abreviado, el solicitante debe basarse en los documentos FDA .
- Identificación del dispositivo predicado: Dispositivos Médicos debe demostrar que el dispositivo que pretende comercializar tiene el mismo uso previsto y las mismas características técnicas que el dispositivo comercializado legalmente, también conocido como dispositivo predicado. Si existen diferencias en las características técnicas, el solicitante debe demostrar que dichas diferencias no plantean problemas de seguridad y eficacia.
Paso 2- Preparación del expediente 510(k)
El siguiente paso es preparar el expediente 510(k), la guía y la información, que está disponible en el FDA . Incluye la lista de verificación de aceptación para los tres (03) tipos de programas 510(k) y un micrositio titulado «Contenido para 510(k)», que incluye información sobre las declaraciones de indicaciones de uso, la comparación de equivalencia sustancial y el etiquetado propuesto, entre otra información útil.
Pasos del proceso de presentación de 510(k)
Paso 3: Pago de la tasa FDA
Todos los tipos de solicitudes 510(k) están sujetos a la tasa de usuario. Para el ejercicio 2023, la tasa estándar para 510(k) es de 19.870 dólares. Para las empresas certificadas por el Centro de Diagnóstico y Salud Radiológica (CDRH), también conocidas como pequeñas empresas, la tasa es de 4.967 dólares. La tasa está sujeta a cambios en el próximo ejercicio.
Paso 4- Presentación de la solicitud 510(k)
El remitente puede enviar una copia electrónica (eCopy) o una presentación electrónica (eSTAR) previa a la comercialización a través del portal del CDRH.
A partir del 1 de octubre de 2023, todas las presentaciones 510(k), a menos que estén exentas de acuerdo con la guía final, deben presentarse como presentaciones electrónicas utilizando eSTAR.
Después de presentar el formulario 510(k), se asigna un número de control único, conocido como «número 510(k)» o «número K». FDA dos comprobaciones de verificación: una para verificar si se ha pagado la tasa de usuario correspondiente y otra para verificar si se ha proporcionado una copia electrónica o un eSTAR válidos.
- Para el día 07, FDA una carta de acuse de recibo en caso de que se haya pagado la tasa de usuario correspondiente y se haya proporcionado una copia electrónica o un eSTAR válidos. De lo contrario, la FDA una carta de retención por cuestiones pendientes.
- En el día 15, FDA una revisión de aceptación. FDA al solicitante si la 510(k) es aceptada para su revisión sustantiva o si se coloca en espera por rechazo de aceptación (RTA).
- Al cabo de 60 días, FDA una revisión sustantiva. FDA a través de una interacción sustantiva
para informar de que FDA con una revisión interactiva o que la 510(k) quedará en suspenso y se solicitará información adicional.
Paso 5: FDA e inclusión en la base de datos FDA (k) FDA
El objetivo de la FDA anunciar su decisión sobre las enmiendas a las tasas Dispositivos Médicos (MDUFA) en un plazo de 90 FDA . FDA son los días naturales transcurridos entre la fecha de recepción del 510(k) y la fecha de la decisión de la MDUFA, excluyendo los días en que la solicitud estuvo en espera por una solicitud de información adicional. Las decisiones de la MDUFA para las solicitudes 510(k) incluyen conclusiones de equivalencia sustancial (SE) o no equivalencia sustancial (NSE).
Cuando se toma una decisión, FDA una carta de decisión al solicitante por correo electrónico. Una solicitud 510(k) que recibe una carta de decisión SE se considera «aprobada». A continuación, se incluye en la base de datos 510(k) junto con las indicaciones para el uso de los Dispositivos Médicos el resumen 510(k) o la declaración 510(k) como archivos adjuntos.
Se puede concluir que una planificación y ejecución cuidadosas, mediante una documentación exhaustiva y un conocimiento profundo del entorno normativo, son fundamentales para que la presentación de la solicitud 510(k) a FDA sea satisfactoria.
Si necesita ayuda con el proceso de presentación del formulario 510(k) de sus Dispositivos Médicos, puede escribirnos a sales@freyrsoltions.com o programar una llamada con nuestros expertos, quienes le ayudarán a completar los trámites. Manténgase informado. Cumpla con la normativa.









