
Los productos sanitarios se someten a una evaluación de conformidad antes de ser incluidos en la lista ARTG para garantizar que cumplen los principios esenciales exigidos por la Therapeutic Goods Administration (TGA) de Australia. Los principios esenciales básicamente describen las características de seguridad y funcionamiento que debe cumplir cualquier producto para que pueda venderse en Australia. Al igual que en la UE, en Australia la evaluación de la conformidad se basa en la clase de riesgo del producto. Por lo tanto, la ruta de evaluación de la conformidad que debe seguir cualquier dispositivo depende de su clasificación.
Existen varias normas reglamentarias que se aplican a diversos tipos de dispositivos. El cumplimiento de una o varias normas es un requisito esencial. La identificación de las normas pertinentes aplicables al dispositivo y la posterior prueba del dispositivo para demostrar su conformidad con la norma se convierte en un requisito previo.
La evaluación de la conformidad implica un examen sistemático de los documentos técnicos relacionados con el dispositivo. La gestión de riesgos, la evaluación clínica, el proceso de fabricación y las actividades de vigilancia realizadas por el fabricante son los aspectos críticos que se evalúan. Los dispositivos que deben contar con un certificado de evaluación de la conformidad de la TGA se enumeran en la norma 4.1 del Reglamento sobre productos terapéuticos (dispositivos médicos) de 2002. Si bien el certificado de evaluación de la conformidad expedido por la TGA es un requisito previo para la comercialización de la mayoría de los dispositivos médicos en Australia, la TGA también acepta los certificados de evaluación de la conformidad expedidos por los organismos notificados en Europa. Además, la TGA también acepta las evaluaciones de conformidad de los países que forman parte del MDSAP Programa de AuditoríaDispositivos Médicos ).
Los requisitos de evaluación de la conformidad varían en función de la categoría de riesgo del producto. El cuadro nº 1 detalla el proceso de evaluación de la conformidad basado en la clasificación en Australia.
Proceso de evaluación de la conformidad - Australia
Clase | Procedimiento de evaluación de la conformidad | Responsabilidades del fabricante |
| I | Parte 6 (Declaración de conformidad, que no requiere evaluación por parte de la Secretaría) | Documentación que demuestre la conformidad con los Principios Esenciales |
| I (medición) y IIa (no estéril) | Parte 6 (Declaración de conformidad, que no requiere evaluación por parte de la Secretaría) Parte 5 (Sistema de gestión de la calidad del producto) | Documentación que demuestre la conformidad con los Principios Esenciales. Implantar el sistema de gestión de la calidad de los productos para la inspección final y las pruebas para las auditorías. Nota: La presentación de la Declaración de Conformidad no es necesaria para la Clase I (no medible y no estéril), pero debe estar disponible a petición de la TGA. |
| I (estéril) y IIa (estéril) | Parte 6 (Declaración de conformidad, que no requiere evaluación por parte de la Secretaría) Parte 4 (Garantía de calidad de la producción) | Documentación que demuestre la conformidad con los Principios Esenciales. Implementar un sistema de gestión de calidad que excluya el elemento de diseño, basado en la norma ISO 13485. |
| IIb | Parte 1 (Garantía de calidad total) excluido el apartado 1.6 (Examen del diseño) | Implementar un sistema de gestión de calidad integral que incluya el diseño, la producción, el etiquetado, el embalaje y la inspección final, basado en ISO 13485. Se excluye el expediente de diseño. |
| III Y AIMD | Parte 1 (Garantía de calidad total), incluido el apartado 1.6 (Examen del diseño) | Implementar un sistema de gestión de calidad integral que incluya el diseño, la producción, el etiquetado, el embalaje y la inspección final, basado en ISO 13485. Diseñar el expediente de acuerdo con los Principios Esenciales. |
| Sistemas o paquetes de procedimientos Parte 7 | (Procedimientos para productos sanitarios utilizados con fines especiales) | Principios esenciales. Procedimiento de evaluación de la conformidad. Pruebas clínicas de cada componente del sistema o envase. |
Cuadro nº 1 Requisitos de evaluación de la conformidad de los productos
El proceso habitual de aprobación de productos sanitarios por parte de la TGA es el siguiente:
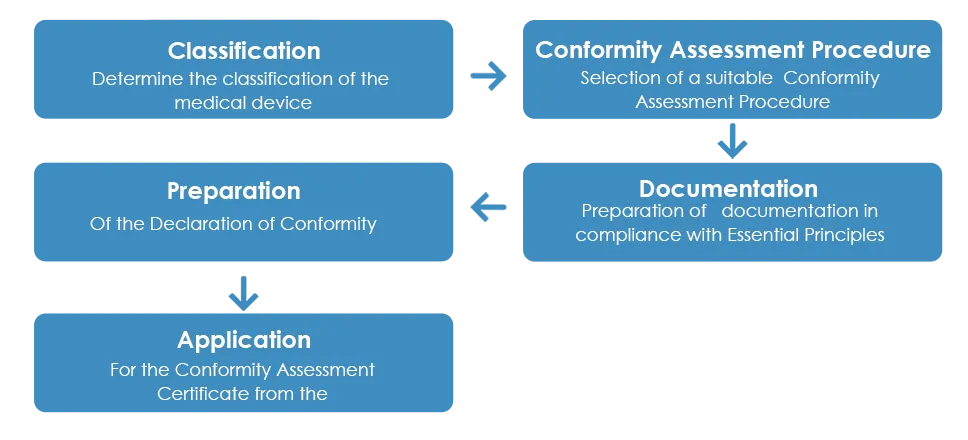
Como se ha detallado anteriormente, una vez recibido el Certificado de Evaluación de Conformidad de la TGA, el fabricante debe preparar una Declaración de Conformidad (DoC) en la que declare que los Dispositivos Médicos con los principios esenciales aplicables, las normas de clasificación y la vía de evaluación de la conformidad. Sin embargo, a diferencia del Certificado de Evaluación de Conformidad, la TGA no acepta las DoC europeas.
El mercado australiano ofrece un panorama prometedor para Dispositivos Médicos , siempre y cuando se cumplan los requisitos reglamentarios de la Administración de Productos Terapéuticos (TGA). Los requisitos de conformidad y el proceso de evaluación varían según la clase de riesgo del dispositivo y el IVD. Aunque la Dispositivos Médicos está bien definida y es transparente, su aplicación es compleja y los fabricantes pueden solicitar la ayuda de socios reguladores para que el dispositivo sea incluido con éxito en la lista.
Para obtener información completa sobre los requisitos de evaluación de la conformidad, el patrocinador australiano y la lista ARTG en Australia, póngase en contacto con un experto en normativa. Manténgase informado. Cumpla la normativa.









