
Quality Management System (QMS) un componente esencial de Dispositivos Médicos , ya que garantiza la seguridad, la eficacia y el cumplimiento normativo de los dispositivos médicos a lo largo de su ciclo de vida. El SGC se aplica en todas las etapas del Dispositivos Médicos , incluida la fase de diseño y desarrollo, para garantizar que el dispositivo cumpla con los requisitos normativos y de los usuarios, y que se identifiquen y aborden los posibles riesgos.
Figura 1: Etapas del ciclo Dispositivos Médicos
En este blog, analizaremos la importancia delSGC en la fase de diseño y desarrollo del ciclo Dispositivos Médicos de Dispositivos Médicos .
Fase de diseño y desarrollo en el ciclo Dispositivos Médicos
La fase de diseño y desarrollo es una de las etapas más críticas en el ciclo de vida de un Dispositivos Médicos. Durante esta etapa, se desarrolla el diseño del dispositivo y se crean prototipos, seguidos de pruebas de verificación y validación como parte del ciclo Dispositivos Médicos .
Para garantizar que los Dispositivos Médicos los requisitos reglamentarios, la seguridad, la eficacia y las expectativas de los usuarios, la implementación de un Quality Management System (QMS) es esencial en la etapa de diseño y desarrollo del ciclo de vida de un Dispositivos Médicos.
La documentación es crucial durante la fase de diseño y desarrollo de los productos sanitarios. El SGC garantiza el control, la gestión y la documentación de toda la documentación relacionada con el diseño y el desarrollo.
Design History File (DHF) un archivo/registro importante que contiene toda la documentación relacionada con el diseño y el desarrollo del dispositivo. El DHF proporciona la prueba de que el diseño del dispositivo cumple con los requisitos reglamentarios.
El DHF debe contener documentación relativa a las entradas y salidas del diseño, las revisiones del diseño, la verificación del diseño, la validación, los cambios en el diseño y la gestión de riesgos. Obtenga más información sobre el DHF aquí.
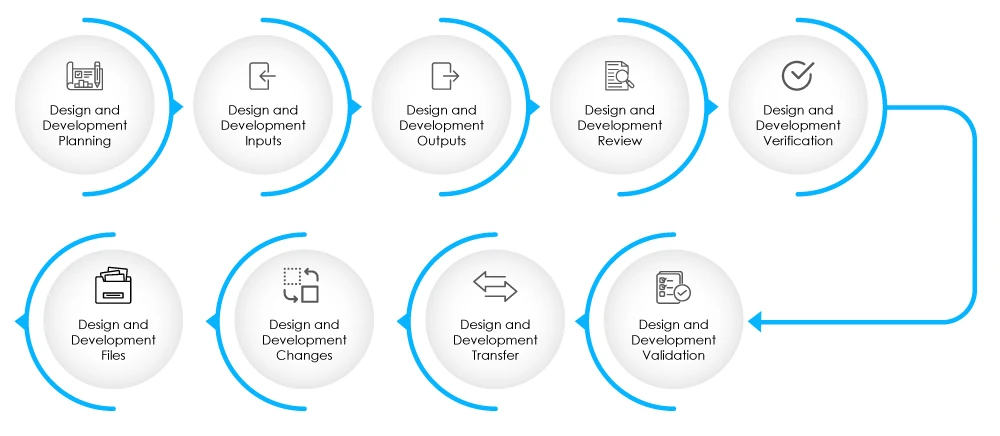
Fig. 2-Etapas de la fase de diseño y desarrollo
Buenas prácticas para la fase de diseño y desarrollo
- Establecer un enfoque estructurado: Desarrollar un enfoque estructurado para el desarrollo y la gestión del DHF que se adapte a las necesidades específicas de su organización. Este enfoque debe incluir directrices, procedimientos y flujos de trabajo claros para el desarrollo y la gestión del DHF.
- Definir y documentar las entradas de diseño: Defina y documente claramente las entradas de diseño, incluidos los requisitos y las especificaciones del dispositivo. Esto puede ayudar a garantizar que el DHF sea exhaustivo y completo.
- Gestione los cambios de diseño: Implemente un sólido proceso de gestión de cambios que incluya procedimientos para documentar, evaluar y aprobar los cambios de diseño. Esto puede ayudar a garantizar que los cambios se documenten y evalúen adecuadamente por su impacto en la seguridad y eficacia del dispositivo.
- Garantizar la trazabilidad: Elabore una matriz de trazabilidad que vincule las entradas de diseño con las salidas de diseño y asegúrese de que todas las actividades de diseño y desarrollo están debidamente documentadas y registradas. Esto puede ayudar a garantizar la trazabilidad del DHF y a que el proceso de toma de decisiones esté bien documentado.
- Equilibrar innovación y cumplimiento: Desarrollar una cultura de innovación al tiempo que se garantiza el cumplimiento de los requisitos de conformidad relacionados con el DHF, como los controles de diseño y la gestión de riesgos. Esto puede lograrse desarrollando procedimientos y flujos de trabajo que faciliten la innovación al tiempo que garantizan el cumplimiento de los requisitos normativos.
- Implementar el control de documentos: Implementar procedimientos de control de documentos que garanticen que los documentos del DHF estén debidamente controlados, controlados por versiones y accesibles al personal autorizado. Esto puede ayudar a garantizar que los documentos DHF estén seguros y que los cambios estén debidamente documentados y aprobados.
- Formar al equipo: Asegúrese de que el equipo responsable del desarrollo y la gestión del DHF recibe la formación adecuada sobre los requisitos del DHF y cuenta con los conocimientos técnicos necesarios para desarrollar el producto. Esto puede lograrse mediante sesiones de formación periódicas, tutorías y la contratación de profesionales experimentados con las habilidades y conocimientos necesarios.
Al seguir estas mejores prácticas, la Dispositivos Médicos puede garantizar el cumplimiento de los requisitos normativos, promover la seguridad y eficacia de sus productos y mantener su ventaja competitiva en el mercado.
En conclusión, la implementación de un sistema de gestión de calidad desde la fase de diseño y desarrollo es fundamental para el éxito en el Dispositivos Médicos , altamente regulado. Mediante el mantenimiento de registros sistemáticos y el cumplimiento de los requisitos normativos,Dispositivos Médicos puede garantizar que ofrece productos de alta calidad y mantiene la satisfacción de los clientes.
En Freyr, ofrecemos servicios de QMS para ayudar a Dispositivos Médicos a cumplir con los requisitos normativos en todas las etapas del ciclo Dispositivos Médicos .Póngase en contactocon nuestros expertos en QMS y normativa para obtener más información.









