
El protocolo de validación se define como un plan documentado para probar un Dispositivos Médicos confirmar que el proceso de producción utilizado para fabricar el producto cumple con los requisitos específicos del usuario, técnicos y reglamentarios. Esto incluye una revisión de las variables del proceso y las limitaciones operativas, así como el análisis de los resultados de las pruebas en condiciones de uso reales.
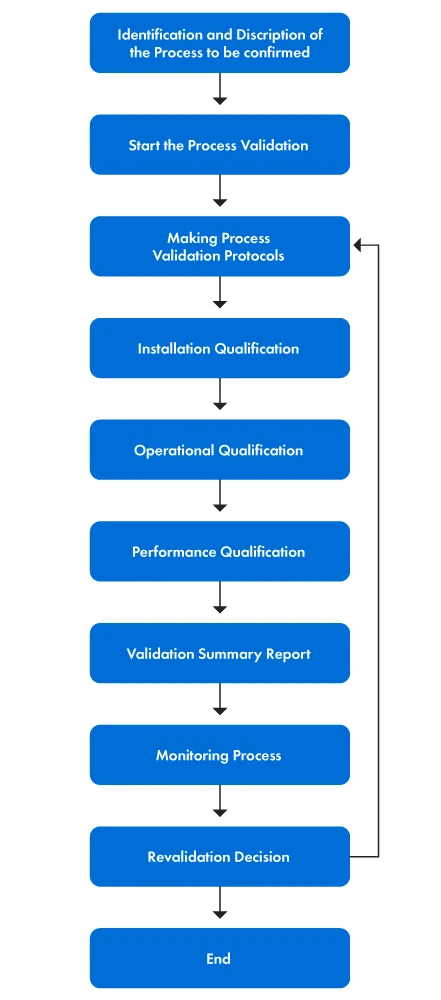
El proceso de validación implica varias acciones tangibles. Las etapas se dilucidan del siguiente modo:
- En primer lugar, se forma el equipo de validación y se asignan funciones y responsabilidades específicas a cada miembro. El objetivo de la validación del proceso es proporcionar una declaración clara de los objetivos de la validación y definir el alcance de las actividades de validación, especificando los aspectos de los Dispositivos Médicos se están validando. A continuación, el equipo comprende los principios subyacentes del proceso para identificar los parámetros específicos y los resultados deseados.
- En segundo lugar, se establecen los criterios de evaluación y aceptación, junto con la selección de métodos de ensayo, herramientas y técnicas de análisis estadístico adecuados. A continuación, se redactan los protocolos de validación del proceso y se ponen en marcha la Cualificación de la Instalación (IQ), la Cualificación Operativa (OQ) y la Cualificación del Rendimiento (PQ).
- Por último, se determinan los controles del proceso en curso y las medidas de seguimiento para garantizar la validación continua del proceso. Siempre que sea necesario, se realiza una revalidación para mantener la precisión y eficacia del proceso de validación.
La figura 1 representa paso a paso el proceso de validación.
Figura 1: Etapas del proceso de validación
PVP
Debido a la amplia gama de volúmenes de producción y complejidades de fabricación, existen numerosos enfoques para llevar a cabo la validación de procesos. Sin embargo, las regulaciones de la Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA) y ISO 13485 sugerencias limitadas sobre métodos específicos. No obstante, una fuente ampliamente reconocida y autorizada para la validación Dispositivos Médicos es un documento de orientación del Grupo de Trabajo para la Armonización Global (GHTF), ahora denominado Foro Internacional Dispositivos Médicos (IMDRF), publicado en 2004. Sigue siendo la referencia principal incluso en el sitio web oficial USFDA.
Según el documento de orientación, se forma un equipo de validación para crear un Plan de Validación de Procesos (PVP) detallado. Los protocolos de validación de procesos incluyen un esquema detallado sobre cómo aplicar la IQ, la OQ, la PQ y la revalidación. El PVP debe contener los siguientes elementos
- Definir el dispositivo y determinar el enfoque de validación.
- Identificar los elementos que requieren validación.
- Realización de actividades en el lugar designado.
- Esbozar el alcance de la documentación.
- Creación de un calendario para las actividades de validación.
- Elaboración de un programa general.
- Mantener una lista exhaustiva y referencias de las validaciones internas y externas que se hayan realizado.
El protocolo de validación se redacta antes de llevar a cabo las actividades de validación. Debe ser elaborado por el equipo de validación y aprobado por el departamento correspondiente. El objetivo de un protocolo de validación es definir los guiones de prueba que deben seguirse para garantizar que los procesos y equipos estén listos para fabricar Dispositivos Médicos seguros y eficaces.
Forma parte del protocolo de validación un informe analítico que contiene información junto con los análisis, explicaciones y recomendaciones necesarias. Estos registros se revisan además para garantizar que se cumplen los dos (02) criterios siguientes:
- Cumplimiento de las normas reglamentarias.
- Todos los registros y datos generados se revisan para comprobar sus resultados, adecuación e integridad.
La figura 2 representa el PVP y los distintos procesos que intervienen en él.
Figura 2: El PVP y sus requisitos
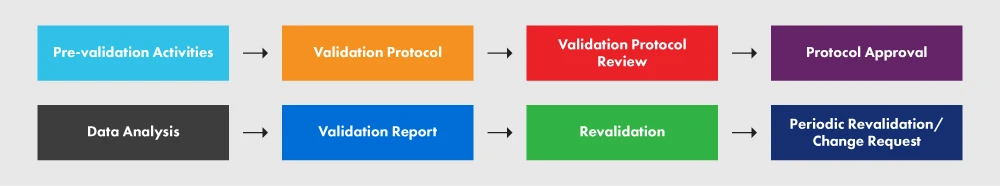
Un protocolo redactado adecuadamente proporciona directrices, políticas y procedimientos claros que deben respetarse durante la validación del proceso. Abarca aspectos como las instalaciones, el equipo, los métodos y la formación. El protocolo especifica las entradas y límites del proceso, así como los pasos esenciales para ejecutar con éxito el proyecto de validación del proceso. Aunque el siguiente esquema no abarca todos y cada uno de los elementos necesarios en su protocolo, le ofrece una visión general del nivel de detalle requerido. Le recomendamos encarecidamente que siga el documento de orientación para comprender mejor el proceso.
- Portada
- Productos cubiertos
- Equipo/proceso a validar
- General
- Objetivos
- Documentos de referencia
- Plan de validación
- CI
- OQ
- PQ
- Equipos de medición/prueba y calibración
- Mantenimiento de equipos
- Revalidación
- Página de aprobación/firma del equipo de validación
La gestión de operaciones desempeña un papel crucial en el mantenimiento de un rendimiento óptimo mediante el seguimiento de las medidas clave, la revisión de los métodos y procedimientos de trabajo y la adopción de medidas rápidas cuando surja algún problema. En los casos en que surjan problemas, es posible que tenga que revalidar un proceso parcial o incluso totalmente. Según la sección 820.75(c) del Reglamento de sistemas de calidad (QSR) USFDA , la revalidación del proceso debe considerarse en estas circunstancias: "Cuando se produzcan cambios o desviaciones del proceso, el fabricante deberá revisar, evaluar y realizar la revalidación según corresponda. Estas actividades deben documentarse".
Entre los posibles desencadenantes de la revalidación del proceso se encuentran las modificaciones de las especificaciones, los métodos, los procedimientos, los programas informáticos, los diseños, los componentes clave, el escalado de lotes, los cambios de ubicación, los cambios de equipos y similares. Además, la aplicación de acciones correctivas y preventivas (CAPA) también puede servir como desencadenante de la revalidación del proceso. Las principales razones para la revalidación son las siguientes:
- Cambios introducidos en el proceso.
- Tendencia negativa de la calidad, deterioro repentino de la calidad o aumento de las reclamaciones de los clientes.
- Importante ampliación de la capacidad de la línea.
- Cambios en el diseño.
- Cambios en el envasado de los productos.
- Transferencia de un proceso a otra instalación.
- Cambios en el proceso de solicitud.
Para obtener más información sobre los protocolos de validación y su importancia en el campo de Dispositivos Médicos , consúltenos. ¡Manténgase informado! ¡Cumpla con la normativa!









