
Sabia que? É possível poupar até um milhão nos próximos três (03) anos introduzindo a Garantia de Software Informático (CSA) em vez do atual modelo de Validação de Sistemas Informáticos (CSV)!
Ao longo dos anos, as organizações farmacêuticas incorporaram a CSV, uma abordagem de validação baseada no risco para garantir que os sistemas operativos informáticos estão em conformidade com os requisitos regulamentares.
À medida que a indústria se prepara para a próxima transformação (além de uma abordagem baseada no risco), que é a CSA, USFDA lançar novas orientações sobre a CSA em 2022 para ajudar as organizações a compreender a qualidade do produto e a conformidade regulamentar. Espera-se que as orientações proporcionem uma compreensão clara de como, onde e quais medidas devem ser tomadas para realizar uma Avaliação de Risco de Software bem-sucedida.
Vamos agora discutir amplamente a comparação entre CSV e CSA numa perspetiva de processo, pessoas e tecnologia; e como uma implementação bem sucedida de CSA pode proporcionar benefícios tangíveis a uma organização.
Processo
A validação de sistemas informáticos (CSV) é uma abordagem documentada centrada na conformidade que actua como prova de que o sistema é adequado para o fim a que se destina.
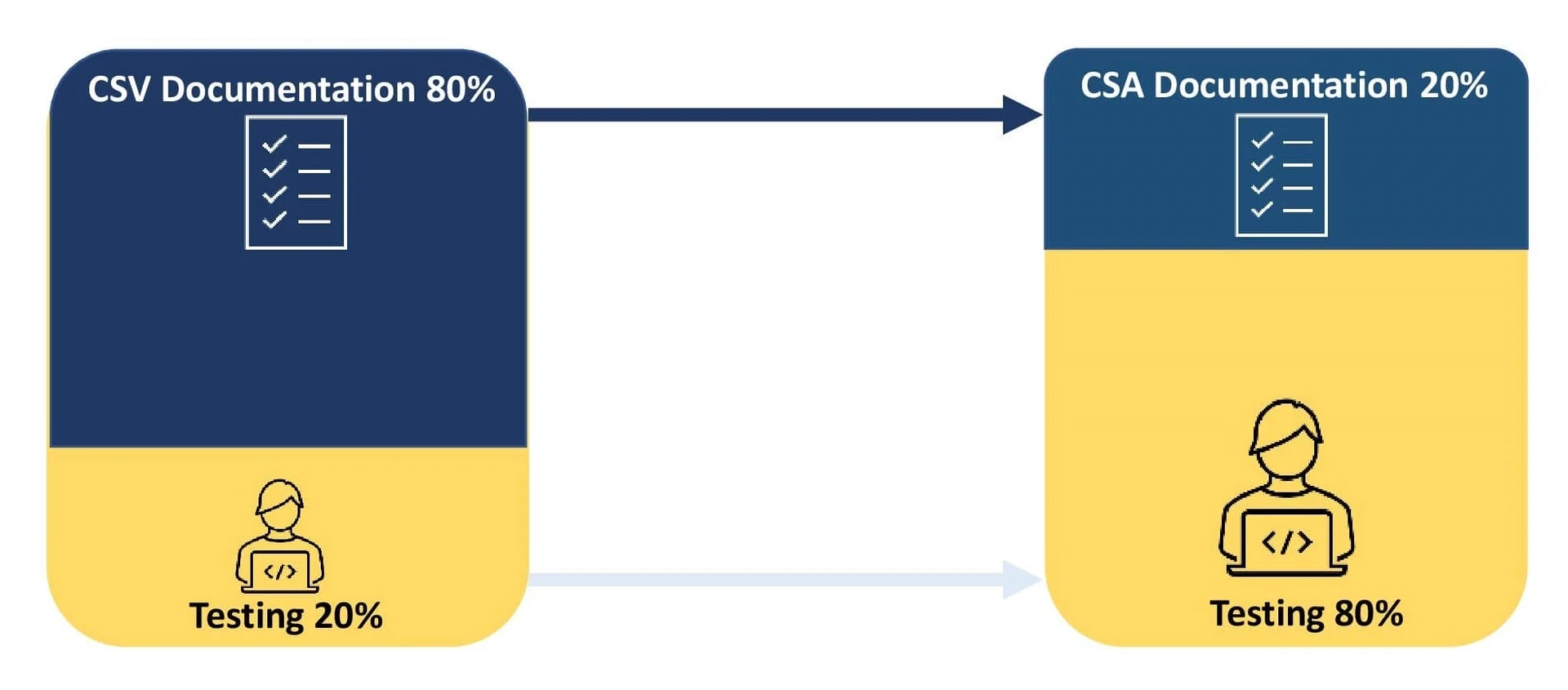
Uma organização investe 80% do seu esforço na documentação do processo de validação e 20% nos testes. Quaisquer discrepâncias nos testes de CSV em associação com os resultados esperados necessitam de documentação e implementação de um plano de ação corretiva.
A Garantia de Software Informático (CSA) é uma abordagem centrada na qualidade que realça o impacto que o sistema de software tem na segurança dos pacientes, na qualidade do produto e na integridade dos dados.
O principal objetivo é centrar-se na validação e documentação das actividades de risco de segurança com base na complexidade do software. Esta abordagem incentiva a utilização da digitalização e da automatização, melhorando assim a qualidade do produto. A redução do processo de documentação ajuda as organizações a reagir a problemas críticos de software e a cumprir as orientações das autoridades de saúde. A CSA aproveita os sistemas de qualidade dos fornecedores para efetuar testes sem guião para validar sistemas de baixo risco, permitindo que as organizações invistam 80% dos seus esforços em testes e 20% em documentação.
Portanto, os processos devem ser ajustados (alterados) para refletir a abordagem CSA em diferentes fases do SDLC, o que pode ser alcançado através de:
- Qualidade por Design (QbD) - Priorizar a segurança do paciente e a qualidade do produto garante que o objetivo principal do sistema de software instalado seja atender aos requisitos do utilizador para otimizar a qualidade do produto.
- A estratégia de validação baseada no risco exige testes e documentação vigilantes para sistemas propensos a falhas/defeitos para casos de risco direto e menos para casos de risco indireto ou nulo.
- Repensar o rácio entre documentos e testes permite aos promotores redefinir o seu processo de validação, pedindo-lhes que despendam 80% do esforço em testes e 20% em documentação.
- Proporcionando benefícios tangíveis ao aliviar a pressão da documentação.
Pessoas
O fator de diferenciação entre o CSV e o CSA reside na hierarquia da estratégia. O CSV observa a documentação seguida de testes e pensamento crítico, enquanto que, pelo contrário, o CSA observa o pensamento crítico como o primeiro passo seguido de testes e documentação. A CSV demonstra provas documentadas que fornecem eficiência e eficácia de que um sistema informatizado realiza actividades de acordo com especificações pré-acordadas e atributos de qualidade. Por outro lado, a CSA recomenda que o patrocinador rastreie melhorias no processo para mitigar riscos e possíveis erros.
Ao nível da liderança, alargar o âmbito do pensamento crítico através de múltiplas formas de lidar com situações incertas, uma vez que não existe "uma" forma correta de conseguir algo. O pensamento crítico abrirá portas à inovação para desenvolver produtos fiáveis.
No submissão prático e submissão , treine as pessoas e prepare-as para se transformarem e se adaptarem à CSA por meio de uma colaboração eficaz e programas de treinamento eficazes.
Perspetiva tecnológica
Já existem orientações abrangentes sobre CSV, conforme autoridades regulatórias como USFDA, EMA, MHRA e muitas outras. Então, precisamos da CSA? A resposta é sim. A CSA colocará o objetivo da validação em perspectiva e esclarecerá a disparidade entre patrocinadores e autoridades sanitárias. Existem regulamentos adequados e orientações do setor que as organizações farmacêuticas precisam de compreender para obter benefícios comerciais, simplificando a abordagem do processo de validação. A transição do CSV tradicional para o CSA muda a prioridade da organização do cumprimento das necessidades de conformidade regulamentar para a qualidade e segurança do produto. Essa mudança maximiza o efeito do processo de validação, reduzindo a extensa carga de documentação, o cronograma do projeto e os custos para as empresas de ciências da vida.
Tanto a nível estratégico como operacional, este objetivo pode ser alcançado através do incentivo à digitalização e à automatização, mitigando todos os riscos e erros humanos possíveis.
Conclusão
Como as orientaçõesFDA US sobre CSA ainda não foram publicadas, as organizações farmacêuticas devem começar a pensar e a traçar protocolos para a transição de CSV para CSA de forma proativa. As organizações devem:
- Reavaliar e identificar os sistemas que têm um impacto direto e indireto na segurança dos doentes, na qualidade dos produtos e na integridade dos dados.
- Afetar recursos capazes de assegurar uma transição harmoniosa do processo de validação.
- Efetuar uma análise das lacunas em relação ao sistema existente para identificar eventuais discrepâncias.
A avaliação da abordagem de validação indica o que uma organização pode fazer para efetuar mudanças quando se depara com qualquer problema no sistema. A execução correta do processo de CSV requer um conhecimento profundo do sistema e uma visão das formas de o utilizar.
A necessidade atual das organizações é estabelecer parcerias com especialistas em CSV para moderar projetos simples a complexos e que possam ajudar na transição suave de CSV para CSA. Uma estrutura de revisão de qualidade minimiza o retrabalho no processo de validação do produto e do fornecedor para garantir total conformidade e validação em qualquer fase durante a implementação, manutenção e desativação a um preço extremamente competitivo. Reach com Freyr conformidade.









