Relatório de validade científica (SVR) Visão geral
O Relatório de Validade Científica (SVR) tem uma importância primordial no Relatório de Avaliação do Desempenho (PER) dos Dispositivos de Diagnóstico In Vitro (IVD), de acordo com o Regulamento de Diagnóstico In Vitro da União Europeia (EU IVDR) 2017/746. O SVR desempenha um papel crucial na validação científica do desempenho analítico e clínico do dispositivo, garantindo a segurança e a eficácia dos dispositivos médicos disponíveis no mercado. No âmbito do processo de avaliação da conformidade previsto no RDIV da UE, os fabricantes são obrigados a apresentar um PER, que deve incluir um SVR, a um organismo notificado para demonstrar a segurança e o desempenho do dispositivo antes da sua introdução no mercado da UE.
Relatórios de validade científica para a apresentação do IVDR na UE
- Análise e conclusões
O que constitui o conteúdo do Relatório de Validade Científica (RVC)?
Por validade científica de uma substância a analisar entende-se a associação de uma substância a uma condição clínica ou a um estado fisiológico. A validade científica de um IVD baseia-se principalmente numa das seguintes fontes ou numa combinação das mesmas:
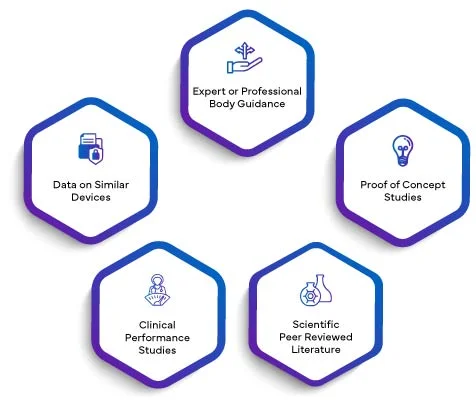
Os dados de todos os itens acima, conforme aplicável, serão redigidos num relatório de validade científica. Ao integrar o SVR no PER, os fabricantes elevam a sua avaliação de desempenho a um nível superior de credibilidade. A validade científica estabelecida através do SVR confere ao PER uma base sólida, melhorando a sua qualidade e significado globais. Isto, por sua vez, infunde confiança nos organismos reguladores, nos profissionais de saúde e nos utilizadores finais, garantindo que o desempenho do IVD é meticulosamente avaliado e validado de acordo com os rigorosos requisitos da UE IVDR 2017/746.
Freyr oferece uma assistência abrangente na preparação de um Relatório de Validade Científica (SVR) robusto para IVDs, permitindo-lhe navegar com confiança no panorama regulamentar e introduzir sem problemas dispositivos IVD seguros e eficazes no mercado.
Relatório de validade científica
- Plano de transição para o cumprimento do IVDR.
- Relatório de validade científica (SVR) baseado na literatura e/ou em dados internos.
- Relatórios de desempenho clínico (CPR) baseados na literatura e/ou em dados internos.
- Relatórios de desempenho analítico (APR)
- Provas clínicas ou relatórios de avaliação do desempenho de acordo com o RIV.
- Plano de avaliação de desempenho.
- Protocolos e relatórios de acompanhamento do desempenho pós-mercado (PMPF).
- Protocolos e relatórios de Vigilância Pós-Comercialização PMSR).
- Redação/revisão de outros documentos, como o folheto informativo/IFU, as instruções de consulta rápida (QRI), o manual de funcionamento/utilizador, etc.

- Conformidade garantida com os recentes regulamentos aplicáveis.
- Equipa de peritos qualificados
- Soluções à medida das suas necessidades
- Gestão de recursos regulamentares/Serviços de aumento de pessoal
- Contribuições multifuncionais de especialistas em Dispositivos Médicos para cumprir os requisitos.





