Visão geral dos serviços de conformidade com o EU MDR
O Regulamento relativo aos dispositivos médicos da UE (MDR) entrou em vigor a 26 de maio de 2021, após o período de transição de 3 anos e uma prorrogação adicional de um ano devido à pandemia de COVID-19. Os dispositivos que estão a ser lançados no mercado da UE devem agora cumprir estes regulamentos e devem ser certificados CE de acordo com o EU MDR pelos organismos notificados acreditados ao abrigo destes regulamentos. No entanto, os dispositivos que já tenham sido certificados CE de acordo com a MDD da UE dispõem de períodos de carência antes de terem de cumprir integralmente os requisitos EU MDR . Durante este período de carência, os dispositivos certificados ao abrigo da MDD da UE e EU MDR co no mercado com o mesmo estatuto e sem serem sujeitos a discriminação. Freyr oferece serviços inigualáveis de conformidade com o EU MDR para ajudar as empresas de dispositivos médicos a cumprir os requisitos do EU MDR atempadamente.
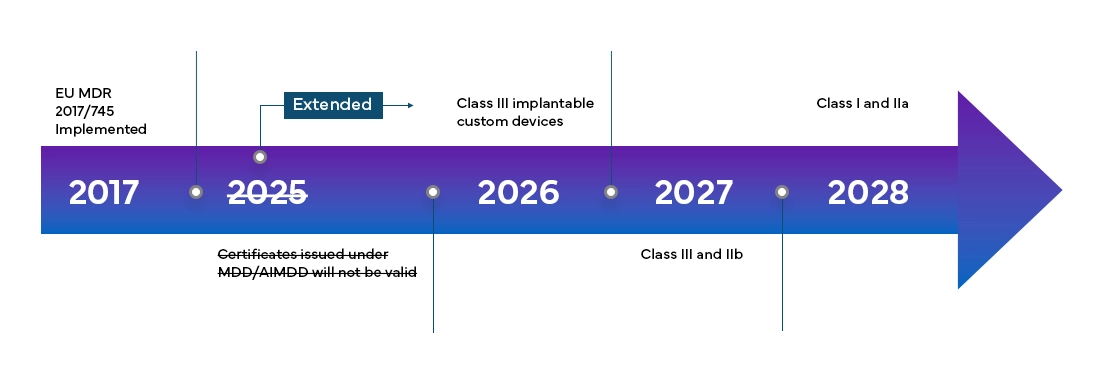
Cronograma de transição e classificações de novos dispositivos
O European Medical Device Regulation (RDM) entrará plenamente em vigor em todos os member states da UE e nos Estados da Associação Europeia de Comércio Livre (EFTA) a partir de maio de 2021 e concede aos fabricantes um período de transição de 4 anos para a certificação completa do RDM da UE.
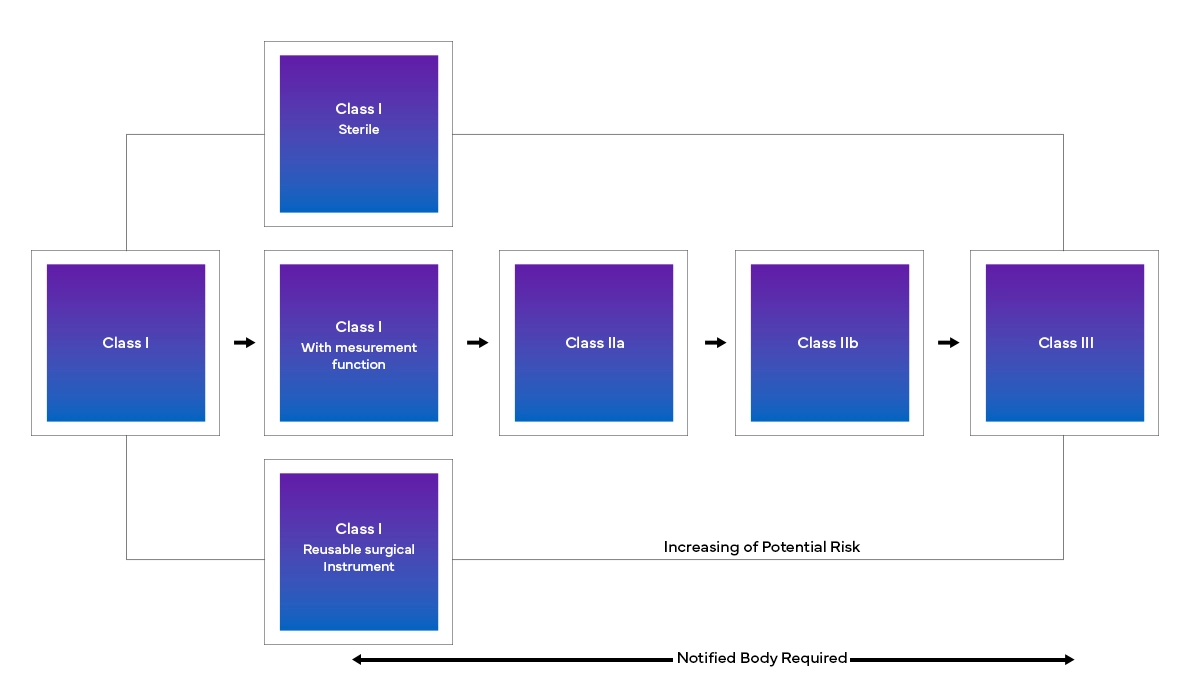
O novo European Medical Device Regulation (MDR), como observado, também trouxe alterações ao atual sistema de classificação dos dispositivos, tais como:
Desde a identificação das alterações exactas a efetuar até à sua implementação em tempo real, os fabricantes poderão ter de navegar por uma série de desafios para cumprir os requisitos do RDM da UE. Desde a descodificação da nova estrutura, passando pela classificação exacta de um dispositivo, até à recolha e apresentação de todos os dados, será necessária uma abordagem regulamentar mais pormenorizada e multifuncional para que os fabricantes possam cumprir os novos regulamentos europeus relativos aos dispositivos médicos. Com uma análise rigorosa das lacunas, Freyr ajuda os clientes com o status-quo e, assim, fornece as acções regulamentares necessárias para a transição e conformidade com o MDR da UE.
Obtenha aconselhamento especializado sobre a sua conformidade com o EU MDR
Serviços de conformidade com o EU MDR
- Desenvolver uma estratégia clara de implementação do Regulamento de Dispositivos Médicos (MDR)
- Compreender a nova legislação, realizar análises de lacunas nos actuais sistemas de gestão da qualidade (SGQ) e nos processos em vigor
- Desenvolver um plano pormenorizado com uma abordagem multifuncional para determinar os aspectos do sistema de qualidade que terão de ser alterados em conformidade com o novo regulamento da UE relativo aos dispositivos médicos
- Formação de várias equipas para analisar o âmbito do produto, a classificação, o tratamento do SGQ, etc., dentro da organização, com um único ponto de contacto em cada equipa
- Atribuição e planeamento de recursos
- Considerar a interação do seu SGQ com outros regulamentos e utilizar esta oportunidade para simplificar os processos, permitindo simultaneamente flexibilidade para incorporar futuras alterações
- Analisar os dados de ensaio em vigor e verificar se existem requisitos adicionais que o MDR estabeleça
- Coordenação das expectativas e do plano de transição com os seus organismos notificados da UE
- Análise de lacunas para dispositivos médicos existentes da MDD da UE para os regulamentos EU MDR
- End-to-end para desenvolver Clinical Evaluation Report (CER), incluindo pesquisa bibliográfica de acordo com as diretrizes European Medical Device Regulation EU MDR).
- End-to-end para Relatórios de Vigilância Pós-comercialização (PMSR), Relatórios Periódicos de Atualização de Segurança (PSUR) e Resumo de Segurança e Desempenho Clínico (SSCP)
- Aumento dos recursos regulamentares com opções de implantação em terra e no mar
- Serviços de Representante Autorizado Europeu (EAR)
- Conformidade com os MDR e assistência na apresentação aos organismos notificados
- Informações regulamentares que abrangem o processo de importação de diferentes mercados regulamentados
- Conformidade do SGQ e auditorias simuladas
- Sistema e ferramenta de gestão de documentos para empresas MDR
- Classificação e reclassificação dos dispositivos em função do risco
- Implementação e consultoria UDI
- Serviços de vigilância pós-comercialização em conformidade com o Regulamento de Dispositivos Médicos da UE
- Consultoria em gestão de riscos ISO 14971
- online interna e online
- Pessoa responsável pelos serviços e assistência em matéria de conformidade regulamentar
- Identificação dos organismos notificados MDR

Para obter suporte end-to-end sobre EU MDR, reach com a Freyr.




