Visão geral dos produtos combinados para dispositivos médicos
No mundo dinâmico dos cuidados de saúde e da inovação, os produtos combinados de dispositivos médicos tornaram-se uma ponte robusta que liga os produtos farmacêuticos, os dispositivos médicos e os produtos biológicos. O mercado de produtos combinados está em um caminho rápido, com uma taxa composta de crescimento anual (CAGR) prevista de 8,9%, de 2023 a 2030. O setor de produtos combinados de medicamentos e dispositivos está pronto para um crescimento sustentado, impulsionado por avanços tecnológicos, infraestrutura de saúde aprimorada, rotas regulatórias mais suaves, colaborações estratégicas e um compromisso com o atendimento centrado no paciente.
Diferentes tipos de produtos combinados
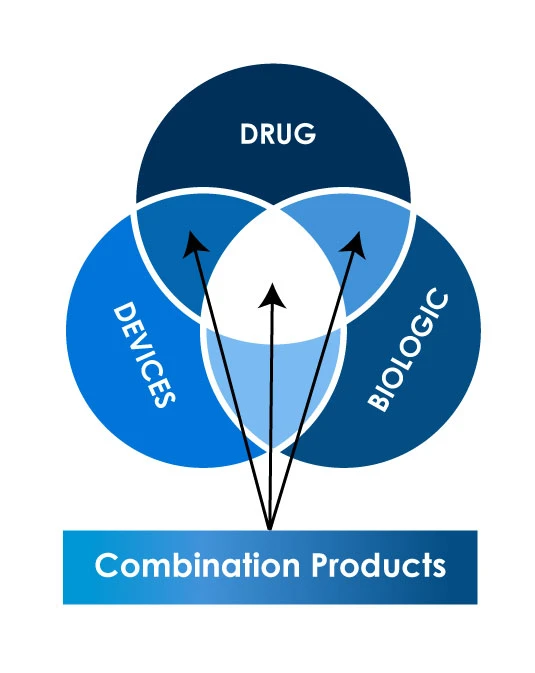
Cenário regulamentar global para o registo de produtos de combinação
A interpretação do que constitui um produto combinado pode diferir de um país para outro, agravando as complexidades do registo de tais produtos em vários países. Além disso, as exigências e os procedimentos regulamentares para os produtos combinados podem apresentar variações em termos de documentação, comunicação e validação. O panorama regulamentar para o registo de produtos combinados pode diferir significativamente em todo o mundo. Eis as principais Autoridades Reguladoras que supervisionam globalmente estes dispositivos.
| País | Agência | Centros de aprovação |
|---|---|---|
| EUA | Gabinete de Produtos Combinados (OCP) | Centro de Avaliação e Investigação de Medicamentos (CDER) |
| Centro de Avaliação e Investigação de Produtos Biológicos (CBER) | ||
| Centro de Dispositivos e Saúde Radiológica (CDRH) | ||
| UE | Organismos Notificados (ON) | Autoridade Nacional Competente (Medicamentos) |
| Organismos notificados (NB) (dispositivos médicos) | ||
| Japão | Evaluation and Licensing Division ou Office of Medical Device/Cellular and Tissue-based Products do Pharmaceutical and Food Safety Bureau | Diretor da Divisão de Avaliação e Licenciamento (DMDL), Gabinete de Segurança Farmacêutica e Alimentar, Gabinete de Segurança Farmacêutica e Médica, Ministério da Saúde e do Bem-Estar |
| China | Centro de Administração da Normalização dos Dispositivos Médicos (CMDSA) | Centro de Avaliação de Dispositivos Médicos (CMDE) |
| Centro de Avaliação de Medicamentos (CDE) | ||
| Malásia | Agência Nacional de Regulamentação Farmacêutica | Agência Nacional de Regulamentação FarmacêuticaNPRA) |
| Agência de Dispositivos Médicos |
O registo de produtos combinados nos mercados internacionais requer uma abordagem personalizada, envolvendo uma colaboração estreita com as Agências de Saúde relevantes para aprovação. O processo típico de registo de produtos combinados envolve as seguintes etapas:
- Avaliar se um dispositivo específico cumpre os critérios de classificação como produto combinado.
- Categorização dos dispositivos com base nos riscos associados.
- Identificar as normas relevantes e os pré-requisitos de dados especificados pela respectiva agência de saúde.
- Gerar os dados necessários, tal como exigido pela Agência.
- Elaboração de um dossier técnico em conformidade com as exigências específicas de cada país.
- Enviar a submissão esclarecer quaisquer dúvidas ou preocupações até que a aprovação seja obtida.
- Gerir o ciclo de vida do dispositivo após a aprovação.
As nossas competências
- Análise de risco inicial
- Estudos de mercado - Informações sobre o mercado específicas do produto
- Aumento do pessoal
- Projeto de estratégia de regulamentação
- Mercados e rotas potenciais
- Ficheiro de conceção e análise de risco
- Quality Management System (QMS) ISO 13485
- Medical Device Single Audit Program MDSAP)
- Pré-avaliação do SGQ ISO 13485
- Estratégia regulamentar
- Freyr IMPACT (Plataforma de Informação Regulamentar)
- Verificação e validação do projeto
- Gestão do risco
- Projeto de documentação técnica
- Estratégia regulamentar
- Requisitos regulamentares
- Ferramenta Freyr rDMS (Sistema de Gestão de Dados/Documentação)
- Validação clínica e de processo
- Rotulagem final e artwork
- Representação no país
- Apresentação de regulamentação
- A marcação "Conformité Européenne" (CE) da União Europeia (UE) e a marcação de Avaliação da Conformidade do Reino Unido (UKCA)
- Certificação de acesso ao mercado mundial
- Apoio à auditoria do Organismo Notificado (ON)/Organismo Aprovado
- Representação no país
- Aprovações regulamentares
- Post-market Surveillance (PMS)
- Acompanhamento clínico pós-comercialização (PMCF)
- Manutenção anual do ficheiro técnico (CER/Gestão de riscos)
- Renovações regulamentares
- Lançamento de novos mercados
- Comunicação da autoridade competente/organismo notificado/organismo aprovado
- Soluções automatizadas de farmacovigilância (PV)
Porquê Freyr?
Registo de Dispositivos Médicos
- Estratégia regulamentar abrangente para produtos combinados.
- Apoio regulamentar a documentos de desenvolvimento de produtos, tais como ficheiros do historial do projeto (DHF).
- Estratégia de conformidade com o SGQ.
- Conformidade regulamentar, análise de lacunas e correção de documentos técnicos e sistemas de qualidade.
- Serviços de rotulagem regulamentar e de redação técnica.
- Serviços de informação regulamentar e de mercado.
- Serviços de tradução de documentos e etiquetas.
- Ligação e serviço da Agência de Saúde.
- artwork regulamentar.
- Serviços de farmacovigilância e PMS.
- Serviços de publicação.
- Serviços de redação médica.

- Apresentações bem sucedidas para várias classes de IVDs.
- Pessoal especializado e dedicado para fornecer apoio regulamentar a dispositivos médicos e IVD.
- Apresentação atempada dos resultados.
- Acesso local às filiais para responder aos desafios da Autoridade e aos requisitos linguísticos específicos.
- Apoio no país ou por um representante legal com um modelo económico.
- Gestão de recursos regulamentares/Serviços de aumento de efectivos.





