Visão geral da FDA eSTAR
A iniciativa FDA foi formulada para aumentar a eficiência e a uniformidade na preparação e avaliação das submissões FDA (k) e De Novo. Com base na abordagem inicial do eSubmitter, que envolvia a submissão eletrónica de dispositivos médicos e aplicações IVD, o programa eSTAR foi estabelecido, aproveitando a experiência anterior FDA. A FDA num programa diferente chamado Programa Piloto de Modelos e Recursos de Submissão Eletrónica (eSTAR). A partir de 1 de outubro de 2023, as submissões 510(k) (Tradicional, Abreviada ou Especial 510[k]) terão de utilizar o programa eSTAR. Os modelos estão disponíveis para online , embora seja necessário utilizar as credenciais FDA para o processo de submissão propriamente dito.
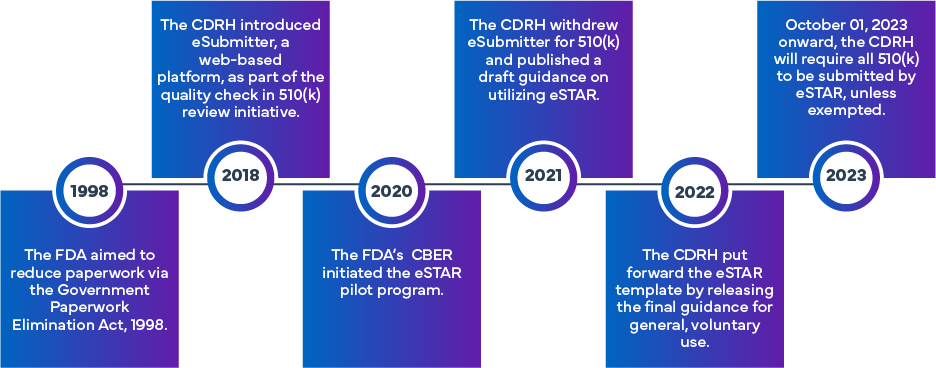
O que é o FDA eSTAR?
O eSTAR é um modelo PDF interativo concebido para facilitar a preparação de uma submissão pré-comercialização abrangente de dispositivos médicos para o processo de aprovação 510(k) FDAnos US. Além disso, os requerentes podem utilizar o eSTAR para enviar respostas aos pedidos de informações adicionais FDA. O seu objetivo é melhorar a qualidade das submissões para vários dispositivos médicos, garantindo que os requerentes forneçam dados completos e de alta qualidade para a análise pré-comercialização FDA.
Ao adotar o formato eSTAR, os transmitentes podem confiar na integridade das suas apresentações, o que, por sua vez, permitirá à FDA realizar análises pré-comercialização de forma mais eficiente e garantir o acesso atempado a dispositivos médicos seguros e eficazes. O modelo eSTAR está disponível gratuitamente e pode ser utilizado voluntariamente por todos os apresentadores de dispositivos médicos para 510(k), De Novo e Q-submissões à FDA. Existem dois tipos de modelos eSTAR - um para dispositivos médicos e outro para IVDs. Em 09 de junho de 2023, a FDA lançou uma versão beta do eSTAR (PreSTAR) para pré-submissões (um tipo de Q-submissões).
Caraterísticas e limitações dos envios eSTAR
Embora o programa eSTAR ofereça um formulário PDF interativo concebido para ajudar os requerentes a elaborarem apresentações completas de dispositivos médicos e de DIV, apresenta vantagens e desvantagens. Os requerentes devem compreender estas vantagens e limitações, com base nas quais podem fazer escolhas bem informadas sobre a integração da eSTAR no seu processo de apresentação. No quadro seguinte, exploraremos os atributos e as restrições do programa eSTAR.

Considerações sobre a utilização eficaz da eSTAR
Uma caraterística vantajosa do modelo eSTAR, que contribui para a otimização do processo de apresentação, é a sua incorporação automática de regulamentos pertinentes e normas reconhecidas para citação. Este facto não só acelera o processo de apresentação, reduzindo a introdução manual de dados, como também reduz a possibilidade de erros humanos que possam ocorrer durante a introdução de regulamentos e normas. Através da construção guiada para cada secção de apresentação, a utilização do eSTAR no processo de apresentação pode ser simplificada sem esforço.
- A FDA sugere o Adobe Acrobat Pro ou o Foxit PDF Editor para editar os modelos eSTAR.
- O eSTAR inclui certos formulários integrados, eliminando assim a necessidade de os preencher separadamente. Estes formulários incluem o Formulário 3514 (a folha de rosto da apresentação) e o Formulário 3881 (indicações de utilização). Além disso, a declaração de veracidade e exatidão, que anteriormente era exigida em papel timbrado da empresa, está agora integrada no eSTAR.
- O eSTAR suporta vários formatos de anexos para além dos PDFs, como folhas de cálculo do Excel e ficheiros de vídeo (mp4).
- Não são permitidos ficheiros em formatos executáveis e activados por macros.
- O tamanho total do ficheiro eSTAR PDF, juntamente com os seus anexos, não deve exceder 1 GB, uma vez que não serão aceites ficheiros com mais de 4 GB.
- Se os seus ficheiros electrónicos ultrapassarem os limites técnicos, pode enviar a apresentação digital para o Centro de Controlo de Documentos do CDRH (DCC) por correio.
Melhores práticas para a preparação de apresentações eSTAR
Seguir algumas das melhores práticas para a preparação de candidaturas eSTAR pode ajudar os candidatos a simplificar o processo de candidatura e aumentar as suas hipóteses de sucesso. Eis algumas das melhores práticas:
- Cumprir as orientações FDA : A FDA oferece orientações para ajudar os candidatos a utilizar com êxito o modelo eSTAR. O cumprimento destas orientações garante que as submissões estão em conformidade com os requisitos e expectativas da FDA.
- Garantir a plenitude: O modelo eSTAR orienta os candidatos através das informações essenciais a apresentar. Os candidatos devem fornecer todos os pormenores exigidos para minimizar as hipóteses de deficiências ou de pedidos de informações adicionais.
- Manter a coerência: O modelo eSTAR promove a uniformidade no conteúdo e na estrutura das submissões 510(k). A construção guiada para cada secção de apresentação ajuda a extrair informações sobre um dispositivo médico.
- Dar prioridade à clareza: Fornecer detalhes claros e concisos nas submissões eSTAR para facilitar um processo de revisão simplificado. Tal pormenorização e precisão minimizam os atrasos e erros, garantindo também o acesso atempado a submissões pré-comercialização de dispositivos médicos.
- Precisão segura: A verificação automática das informações em cada secção das apresentações eSTAR ajuda a reduzir os atrasos na revisão e as potenciais deficiências.
Importância do código de cores na apresentação eSTAR FDA
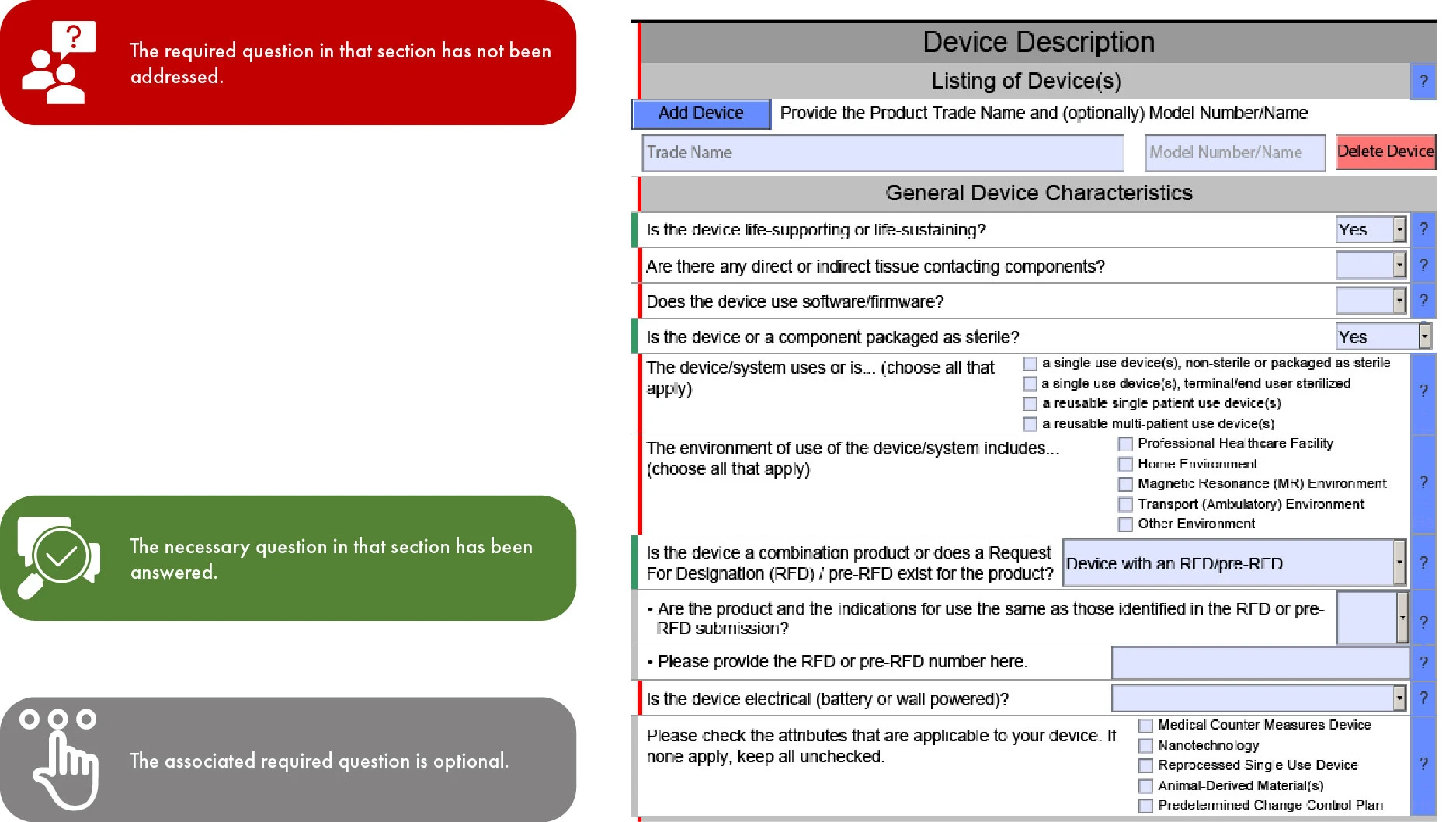
Como o eSTAR se tornará obrigatório para submissões 510(k) a partir de 1 de outubro de 2023 e será voluntário para De Novo, a progressão do modelo pelas secções é determinada pelo tipo de submissão. Esse tipo de simplificação facilita uma análise mais rápida pelaFDA US , minimizando assim inconsistências e omissões na sua submissão. No entanto, é importante observar que a FDA atrasar a sua análise se faltarem traduções em inglês para a documentação fornecida.

Alinhar os anexos
Examine previamente o modelo eSTAR para compreender como os anexos estão divididos e garantir que os seus documentos estão alinhados com as secções dos anexos. Este passo é crucial, particularmente para empresas com submissões 510(k) anteriores, uma vez que a sua abordagem existente relativamente à organização de documentos pode exigir ajustes. Também pode envolver a extração de conteúdo dos anexos.
- O eSTAR exige anexos concisos, diferentes das apresentações tradicionais.
- Espera-se que haja muitos anexos, potencialmente dezenas deles.
- Os anexos permitem a inclusão de dados como folhas de cálculo Excel, ficheiros de vídeo MP4, documentos Word, ficheiros JPEG, etc.
- A eSTAR pretende números de página para as informações anexas, mas não sugere a utilização de uma lista de verificação de recusa de aceitação para as orientações FDA .
Gabaritos: Os modelos estão acessíveis na ligação fornecida: https:fda
O futuro da eSTAR
Prevê-se que o eSTAR seja atualizado após a finalização dos documentos de orientação aplicáveis abrangentes. Com essas atualizações, o fabricante poderá consultar as versões mais recentes emitidas pelaFDA US .
O Ministério Health Canada (HC) lançou uma iniciativa-piloto para utilizar a eSTAR nos dispositivos das classes III e IV. Existe a conjetura de que outras nações poderão imitar o exemplo do Canadá, tornando a adoção da eSTAR discricionária, particularmente no âmbito do consórcio IMDRF. No entanto, é de notar que não houve declarações explícitas para o efeito.
Porquê escolher Freyr?
Freyr possui uma vasta experiência adquirida através do seu envolvimento em numerosos projectos centrados em submissões à FDA no passado. Ao apresentar vias duplas para ajudar proactivamente a indústria a acelerar as submissões 510(k) e De Novo, Freyr fornece uma série de serviços aos clientes, que incluem uma lista abrangente de documentos de submissão essenciais e informações necessárias, a realização de análises meticulosas de lacunas na documentação, a compilação de submissões através do eSTAR e a finalização do pacote de submissão pré-comercialização à FDA. Além disso, Freyr estende o seu apoio a actividades pós-submissão, tais como o fornecimento de informações adicionais e a revisão das respostas da indústria a quaisquer pedidos de informações suplementares apresentados pela FDA.
Como é que Freyr vai ajudar?
Freyr oferece apoio que pode ser útil para se preparar para as submissões 510(k) e De Novo. Os serviços incluem:
- Apoio ao percurso regulamentar: Isto envolve a identificação do código do produto, nome e número do regulamento, potenciais dispositivos de referência, testes de desempenho, bem como as normas aplicáveis e documentos de orientação pertinentes para o dispositivo específico em questão.
- Apoio à submissão de Q (Pré-submissões): Isto envolve ajudá-lo a esclarecer questões relacionadas com os pré-requisitos de uma submissão pré-comercialização, organizar a submissão, preparar-se para uma reunião FDA , interagir com a FDA durante a reunião de uma forma interactiva e redigir as actas da reunião.
A experiência do programa eSTAR FDA
- Estratégia abrangente de regulamentação FDA .
- Identificação do dispositivo predicado.
- Estabelecimento de equivalência substancial com o dispositivo de referência.
- Análise de lacunas para conformidade com FDA .
- Compilação de vinte e uma (21) secções do processo técnico 510(k).
- Publicação e criação da cópia eletrónica.
- Validação e apresentação da cópia eletrónica.
- Serviços de ligação para a aprovação de dispositivos.
- O tratamento das respostas e deficiências do RTA.
- Serviços de consultoria para resolver deficiências.
- Listagem de dispositivos e manutenção da base de dados FURLS.