Visão geral do registo de dispositivos Health Canada
O Canadá, com algumas das diretrizes mais rigorosas, tem um dos melhores sistemas de regulamentação do mundo para dispositivos médicos. No Canadá, todos os dispositivos médicos são regulamentados pela Health Canada, Health Products and Food Branch, Therapeutic Products Directorate, Medical Devices Bureau. Health Canada analisa os Dispositivos Médicos para avaliar a sua segurança, eficácia e qualidade antes de serem autorizados para venda no Canadá, de acordo com o Regulamento de Dispositivos Médicos do Canadá SOR/98-282, implementado em 1998. Freyr tem sido um parceiro ativo das empresas de dispositivos médicos para as ajudar a cumprir as diretrizes de registo de dispositivos médicos Health Canada .
Autoridade reguladora: Health Canada
Regulamento: Regulamentos relativos aos dispositivos médicos (SOR/98-282)
Representante autorizado: Não é necessário
Requisito do SGQ: Conformidade com a ISO 13485:2016 como Medical Device Single Audit Program MDSAP)
Avaliação dos dados técnicos: Health Canada
Validade da licença: Ilimitado
Requisitos de rotulagem: Parte 21 do MDR (SOR/98-282)
Formato de apresentação: Papel
Língua: Inglês e francês
Classificação de dispositivos Health Canada
O sistema de classificação de dispositivos Health Canada é amplamente baseado na Diretiva 93/42/CEE do Conselho da União Europeia. Muitas das regras e interpretações dos termos são semelhantes às propostas pela União Europeia. No entanto, não é necessariamente verdade que um dispositivo médico classificado numa determinada classe de acordo com o sistema de classificação da União Europeia será classificado na mesma classe com base no sistema de classificação de dispositivos médicos do Canadá. O requerente deve seguir as regras estabelecidas nos regulamentos para determinar a classificação adequada para o seu dispositivo no Canadá.
Os seguintes indicadores de risco de um determinado dispositivo foram utilizados para criar as regras de classificação canadianas: grau de invasividade, duração do contacto, sistema corporal afetado e efeitos locais ou sistémicos.
| Classe de dispositivos | Risco |
|---|---|
| I | Baixo |
| II | Baixo-Moderado |
| III | Alta-Moderada |
| IV | Elevado |
Canadá Representante autorizado
Não há exigência para que o fabricante nomeie um Representante Autorizado no Canadá. O distribuidor, no entanto, deve cumprir os Health Canada para Boas Práticas de Distribuição (GDP).
Registo de Dispositivos Médicos - Canadá
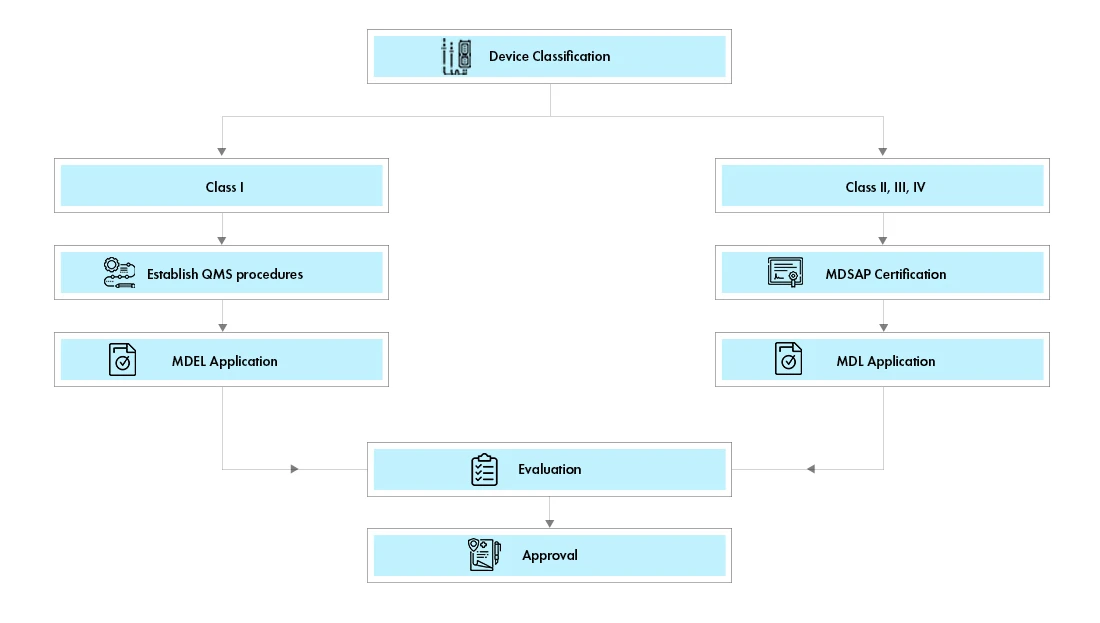
Existem duas vias para o registo de dispositivos médicos no Canadá:
Licença de Estabelecimento de Dispositivos Médicos (MDEL):Os dispositivos de Classe I podem solicitar a Licença de Estabelecimento de Dispositivos Médicos do Canadá (MDEL) preparando os procedimentos obrigatórios e pagando Health Canada .
Licença para Dispositivos Médicos (MDL):Os dispositivos das classes II, III e IV devem solicitar submissão Licença para Dispositivos Médicos Canadenses (MDL). Os requisitos de documentação variam de acordo com a classe do dispositivo.
Fluxo do processo
Gestão do ciclo de vida do dispositivo pós-aprovação
Freyr fabricantes estrangeiros na gestão end-to-end do ciclo de vida dos dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de dispositivos médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção das aprovações e do registo através do pagamento atempado das taxas administrativas e de registo
- Renovação de licenças
- Ligação entre Health Canada o fabricante
Resumo
| Risco | Classe de dispositivos | Auditoria do SGQ | Via de regulação | Requisitos do documento | Health Canada |
|---|---|---|---|---|---|
| Baixo | I | NA | MDEL |
| NA |
| Baixo-Moderado | II | MDSAP | MDL |
| 15 dias |
| Alta-Moderada | III | MDSAP | MDL |
| 60 dias |
| Elevado | IV | MDSAP | MDL |
| 75 dias |
Serviços de registo de dispositivos médicos Freyr
Especialização em Freyr
- Serviços de classificação e agrupamento de dispositivos Health Canada
- Registo de Dispositivos Médicos, Canadá
- Reuniões prévias à apresentação com Health Canada
- MDSAP, Canadá
- Identificação/qualificação do distribuidor para conformidade com Health Canada
- Licença de Estabelecimento de Dispositivos Médicos do Canadá (MDEL)
- Licenciamento de Dispositivos Médicos no Canadá (MDL)
- Gestão de alterações pós-aprovação
- Serviços de rotulagemde acordo com os requisitos Health Canada para dispositivos médicos