Serviços de rotulagem clínica - Visão geral
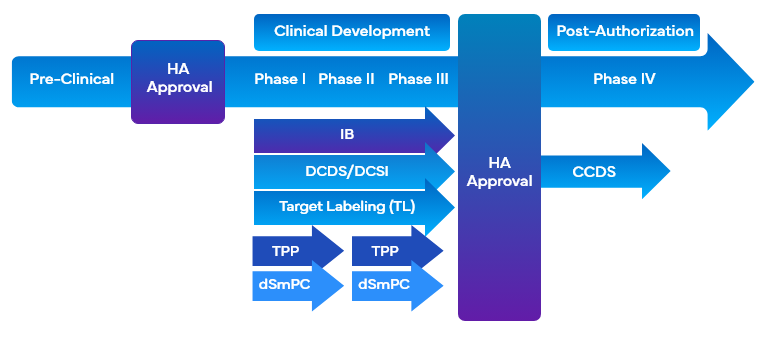
Durante o desenvolvimento de medicamentos, as empresas utilizam uma variedade de ferramentas relacionadas com a rotulagem clínica que empregam a rotulagem direcionada para facilitar o desenvolvimento de medicamentos. Estas ferramentas alinham simultaneamente os objectivos de rotulagem desejados para o marketing e para os ensaios clínicos com a conceção do programa de desenvolvimento ou a conceção do estudo e facilitam a elaboração da Visão Geral ClínicaCO). Algumas das ferramentas de rotulagem clínica que utilizam a rotulagem-alvo durante o desenvolvimento de medicamentos são:
- Brochura do InvestigadorIB)
- Marcação do alvoTL)/Perfil do alvo
- Folha de dados principais de desenvolvimentoDCDS)
- Desenvolvimento de informações de base sobre segurançaDCSI)
- Perfil do produto-alvo FDA TPP)
É importante que as empresas utilizem uma abordagem modular ao recolherem a informação sobre segurança e eficácia em vários tipos de rótulos clínicos para complementar os requisitos de rotulagem clínica. Isto satisfaria a necessidade de ajudar os investigadores e os patrocinadores de forma eficaz, apresentando e actualizando uma secção DCSI específica e focalizada que pode ser convenientemente colocada em diferentes categorias clínicas.
Além disso, DCSI está incluído nas Informações Fundamentais de Segurança da EmpresaCCSI), que constituem a base da primeira Ficha de Dados Fundamentais da EmpresaCCDS) e são utilizadas para a entrada do produto no mercado. A elaboração de um CO bem fundamentado que inclua o âmbito e as questões críticas do programa de desenvolvimento clínico do medicamento também é necessária para apoiar a documentação para os avaliadores.
Serviços de rotulagem clínica da Freyr
Serviços de rotulagem clínica
- Criação e revisão da brochura de investigaçãoIB)
Freyr tem uma experiência considerável na criação, autoria e revisão de IBs para vários programas em fase clínica dos nossos clientes. As BIs são as formas mais recentes de rótulos destinados a fornecer ao investigador ou ao médico assistente informações relevantes sobre o medicamento/intervenção. O seu objetivo é dar aos investigadores e a outras pessoas envolvidas no ensaio as informações necessárias para facilitar a sua compreensão da fundamentação e o seu cumprimento de muitas caraterísticas-chave do protocolo. Estas incluem a dose, a frequência/intervalo da dose, os métodos de administração e os procedimentos de monitorização da segurança. IB contém informações pré-clínicas e clínicas relacionadas com um medicamento experimental.

Ao trabalharem nos IBs, os especialistas em rotulagem clínica da Freyrapresentam a informação de forma concisa, simples, objetiva e equilibrada. As mesmas qualidades também podem ser consideradas aquando da tradução de documentos. Para além da criação de IBs, Freyr também apoia a revisão anual dos IBs e trabalha nas revisões necessárias, em conformidade com os procedimentos padrão estabelecidos pelos clientes e patrocinadores.
- Desenvolvimento da marcação do alvoTL)/perfil do alvo
- Desenvolvimento e revisão de DCDS e DCSI
Freyr tem experiência comprovada na criação de Fichas de Dados Básicos de DesenvolvimentoDCDS) de alta qualidade. A DCDS é um rótulo principal intermediário vital na derivação do conteúdo para os rótulos nacionais de primeiro registo (como USPI, SmPC, etc.). A DCSI é preparada a partir do rótulo-alvo e fornece segurança e eficácia integradas para uma intervenção ou medicamento. A DCSI ajuda os investigadores e os patrocinadores, apresentando e actualizando secções DCDS específicas que podem ser convenientemente colocadas na IB. O DCSI facilita o desenvolvimento do CCSI, que mais tarde se torna parte integrante da Ficha de Dados Essenciais da EmpresaCCDS).
- Desenvolvimento e revisão do perfil do produto-alvo FDA TPP) e do projeto de SmPC da UE (RCMd)
O Perfil do Produto Alvo (TPP)/Rascunho do Resumo das Características do Produto (dSmPC) é um tipo de rótulo clínico que facilita as discussões entre as empresas farmacêuticas e as autoridades sanitárias. O TPP é utilizado ao longo de todo o processo de desenvolvimento de medicamentos, desde submissão de submissão novos medicamentos em investigação (IND) submissão submissão novos medicamentos em investigação (IND) até aos programas pós-comercialização, com o objetivo de obter novas indicações ou outras alterações substanciais na rotulagem dos ensaios clínicos. As empresas farmacêuticas especificam os conceitos de rotulagem que são os objetivos do programa de desenvolvimento de medicamentos na forma de TPP. TPP fornece uma declaração da intenção geral do programa de desenvolvimento de medicamentos e fornece informações sobre o medicamento em uma fase específica do desenvolvimento. Como parceiro regulatório estratégico, a Freyr tem experiência na preparação de TPPs para os US dSmPc para a UE.
- Recursos com conhecimentos regulamentares aprofundados em matéria de embalagem e rotulagem clínica
- Experiência na gestão bem sucedida da rotulagem global e regional de medicamentos para clientes farmacêuticos da Fortune nos EUA, EUROPA, APAC, MENA, etc.
- Experiência em regulamentação global na ajuda a organizações de ciências da vida, nomeadamente fabricantes de produtos farmacêuticos, biotecnológicos e nutricionais
- Redactores médicos altamente qualificados com uma vasta experiência em rotulagem regulamentar
- Conhecimento aprofundado e atualizado das alterações globais à rotulagem de medicamentos de várias autoridades de saúde, como a USFDA, a EMA, a TGA, etc.
- Equipa de conformidade dedicada que acompanha o estado de implementação da ficha de dados principais e da ficha de dados principais da empresaCDSCCDS) nos rótulos regionais
- Especialização em rotulagem de ensaios clínicos e serviços de rotulagem clínica
- Profissionais altamente experientes em rotulagem farmacêutica, biotecnológica e nutricional





