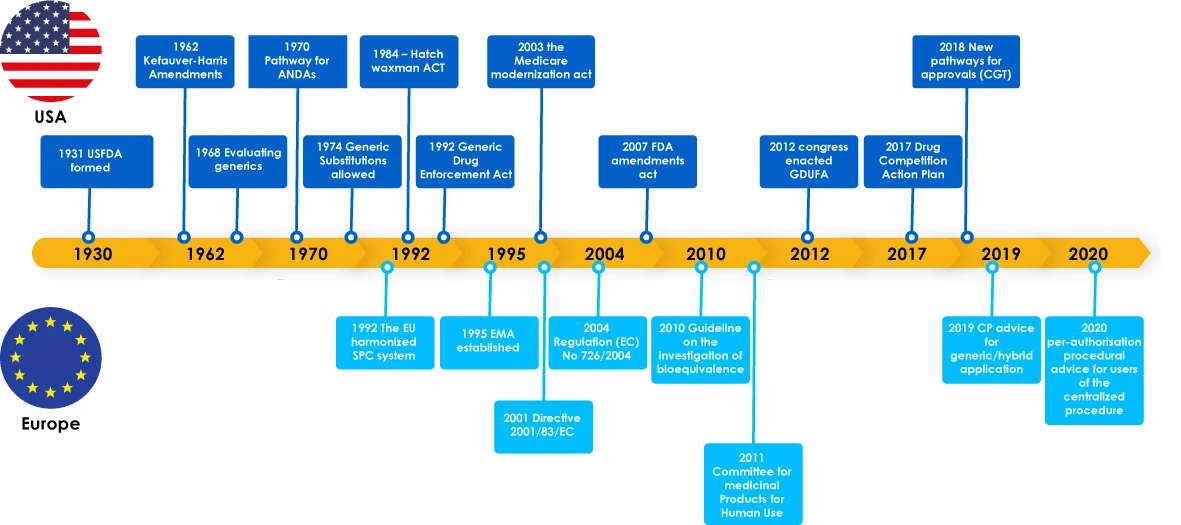
Evolução dos genéricos - Visão geral
Os medicamentos genéricos tiveram marcos importantes, incluindo leis regulamentares para apoiar o desenvolvimento de genéricos, que incentivaram os fabricantes a explorar o mercado de genéricos. Estas legislações também deram confiança aos médicos para prescreverem um substituto para um medicamento de marca, o que acabou por beneficiar os doentes, uma vez que os fabricantes de genéricos satisfizeram as necessidades críticas dos doentes em todo o mundo.
FAQs sobre genéricos
Q1: O que são os medicamentos genéricos?
Resp: Os medicamentos genéricos são medicamentos farmacêuticos, que são cópias idênticas do medicamento original e têm a mesma API, dosagem, uso pretendido, efeitos secundários, via de administração, riscos, segurança e força como o medicamento inovador, mas pode diferir em algumas caraterísticas, tais como, o processo de fabrico, formulação, excipientes, cor, sabor e embalagem. Por outras palavras, um medicamento genérico é terapeuticamente equivalente a um medicamento de marca e, por conseguinte, pode ser substituído pelo seu homólogo de marca.
Q2: Porque é que os medicamentos genéricos custam menos do que um medicamento inovador?
Resp: Os medicamentos genéricos são mais rentáveis quando comparados com o medicamento inovador, porque os medicamentos genéricos não têm de repetir os estudos pré-clínicos e clínicos dispendiosos e demorados, que são necessários para os medicamentos inovadores demonstrarem segurança e eficácia e, em vez disso, os medicamentos genéricos precisam de provar apenas a equivalência farmacêutica do seu produto.
Q3: Os medicamentos genéricos são tão bons como os medicamentos inovadores?
Resposta: Sim, os medicamentos genéricos têm a mesma qualidade, eficácia e segurança que os medicamentos de marca. O preço mais baixo destes medicamentos não indica que sejam de qualidade inferior, porque os medicamentos genéricos, tal como os de marca, têm de passar por um rigoroso processo de aprovação para comercializar o seu produto farmacêutico e as empresas farmacêuticas são obrigadas a apresentar submissão do medicamento genérico, demonstrando que o seu produto farmacêutico tem o mesmo benefício clínico que os medicamentos de marca e é adequado para ser utilizado como substituto do respetivo medicamento de marca.
Q4: Porque é que os medicamentos genéricos têm um aspeto diferente do medicamento de marca?
Resp: Os medicamentos genéricos devem ser bioequivalentes aos medicamentos de marca e ter o mesmo API que os medicamentos inovadores. No entanto, pode haver pequenas diferenças nos medicamentos genéricos no que diz respeito à forma, rotulagem (pequenas diferenças), embalagem e ingredientes inactivos como cor, sabores e conservantes; mas a eficácia do medicamento deve permanecer a mesma.
P5: O que está envolvido na revisão e aprovação de pedidos de medicamentos genéricos nos US?
Resposta: Qualquer empresa farmacêutica que pretenda comercializar o seu medicamento genérico nos US cumprir todos os requisitos regulamentaresFDA US para o registo de medicamentos genéricos e deve demonstrar que:
- O medicamento genérico é "farmaceuticamente/terapeuticamente equivalente" ao medicamento de marca
- O fabricante é capaz de fabricar o medicamento de forma correta e consistente
- O "ingrediente ativo" é o mesmo que o da marca
- A quantidade certa do ingrediente ativo chega ao local do corpo onde tem efeito
- Os ingredientes "inactivos" do medicamento são seguros
- O medicamento não se decompõe com o tempo
- O recipiente em que o medicamento será expedido e vendido é adequado
- O rótulo é o mesmo que o do medicamento de marca
- As patentes ou exclusividades legais relevantes expiraram
Q6: Todos os medicamentos de marca têm um medicamento genérico?
Resp: Não. Nem todos os medicamentos de marca têm uma versão genérica. Os novos medicamentos são fabricados sob proteção de patentes durante um período máximo de vinte (20) anos. Isso significa que nenhum outro medicamento pode ser fabricado e comercializado durante esse período, até a expiração da patente. No entanto, alguns medicamentos podem nunca ter versões genéricas do seu produto, devido à dificuldade de fabrico ou no caso de o medicamento genérico não ser rentável.




