Soluções UDI e GUDID para a visão geral FDA conformidade com FDA
A Regra de Identificação Única de Dispositivos (UDI), promulgada pela Administração US e Medicamentos US (FDA) e publicada no Registo US em 24 de setembro de 2013, impõe requisitos de Identificação Única de Dispositivos (UDI) para dispositivos médicos. Esta regulamentação estabelece um sistema uniforme para identificação de dispositivos e informações associadas, atendendo a vários objetivos de saúde pública, auxiliando notavelmente os esforços de Vigilância Pós-comercialização (PMS) FDA. A conformidade com os requisitos de UDI é obrigatória para os fabricantes que pretendem comercializar os seus produtos nos Estados Unidos.
Um Identificador Único de Dispositivo (UDI) é uma série de caracteres numéricos ou alfanuméricos criados através de uma norma de identificação e codificação de dispositivos globalmente aceite para a identificação inequívoca de um dispositivo médico específico no mercado. O UDI é composto por duas (02) partes: o Identificador de Dispositivo (UDI-DI) e o Identificador de Produção (UDI-PI). O sistema UDI foi concebido para aumentar a rastreabilidade dos dispositivos médicos, melhorar a segurança dos doentes e garantir que os dispositivos são corretamente identificados e utilizados. O fabricante pode obter o UDI junto das agências emissoras de UDI acreditadas FDA : GS1, HIBCC e ICCBBA.

A GUDID (Global Unique Device Identification Database) é um repositório central de informações pormenorizadas sobre dispositivos médicos criado pela FDA. Constitui um requisito regulamentar fundamental para os fabricantes de tecnologia médica que comercializam diagnósticos in vitro (IVD) ou dispositivos médicos nos Estados Unidos. O GUDID contém informações essenciais sobre cada dispositivo. Foi concebido para ajudar a identificar e rastrear todos os dispositivos médicos vendidos nos EUA, proporcionando um centro digital para informações UDI (Unique Device Identification) . Pede-se aos fabricantes que enviem eletronicamente todas as informações UDI para o GUDID, assegurando que os dados exactos e actualizados estão disponíveis para as entidades reguladoras, os prestadores de cuidados de saúde, as seguradoras e o público.
A Freyr possui um escritório nos Estados Unidos com especialistas em regulamentação de dispositivos médicos e recursos para ajudá-lo a estabelecer processos de conformidade para atender aos requisitosFDA US . Para obter assistência especializada, entre em contacto com os especialistas da Freyr.
O que é um número DUNS?
Para enviar informações UDI para o Electronic Submissions GatewayESG) da FDA, os fabricantes nacionais e estrangeiros têm de ter o seu próprio número D-U-N-S único. O número DUNS (Data Universal Numbering System) é um identificador distinto de nove dígitos utilizado para rastrear empresas. Amplamente reconhecido como a norma global para a identificação de empresas, o número DUNS permite que potenciais clientes e fornecedores acedam a informações abrangentes sobre a empresa recolhidas pela Dun & Bradstreet, um fornecedor líder de dados comerciais e empresariais. A FDA exige que todos os detalhes do número DUNS sejam precisos e actualizados para que os registos de dispositivos médicos de uma empresa e as submissões UDI sejam aceites. O não fornecimento de um número DUNS válido pode levar à revogação do registo de uma instalação.
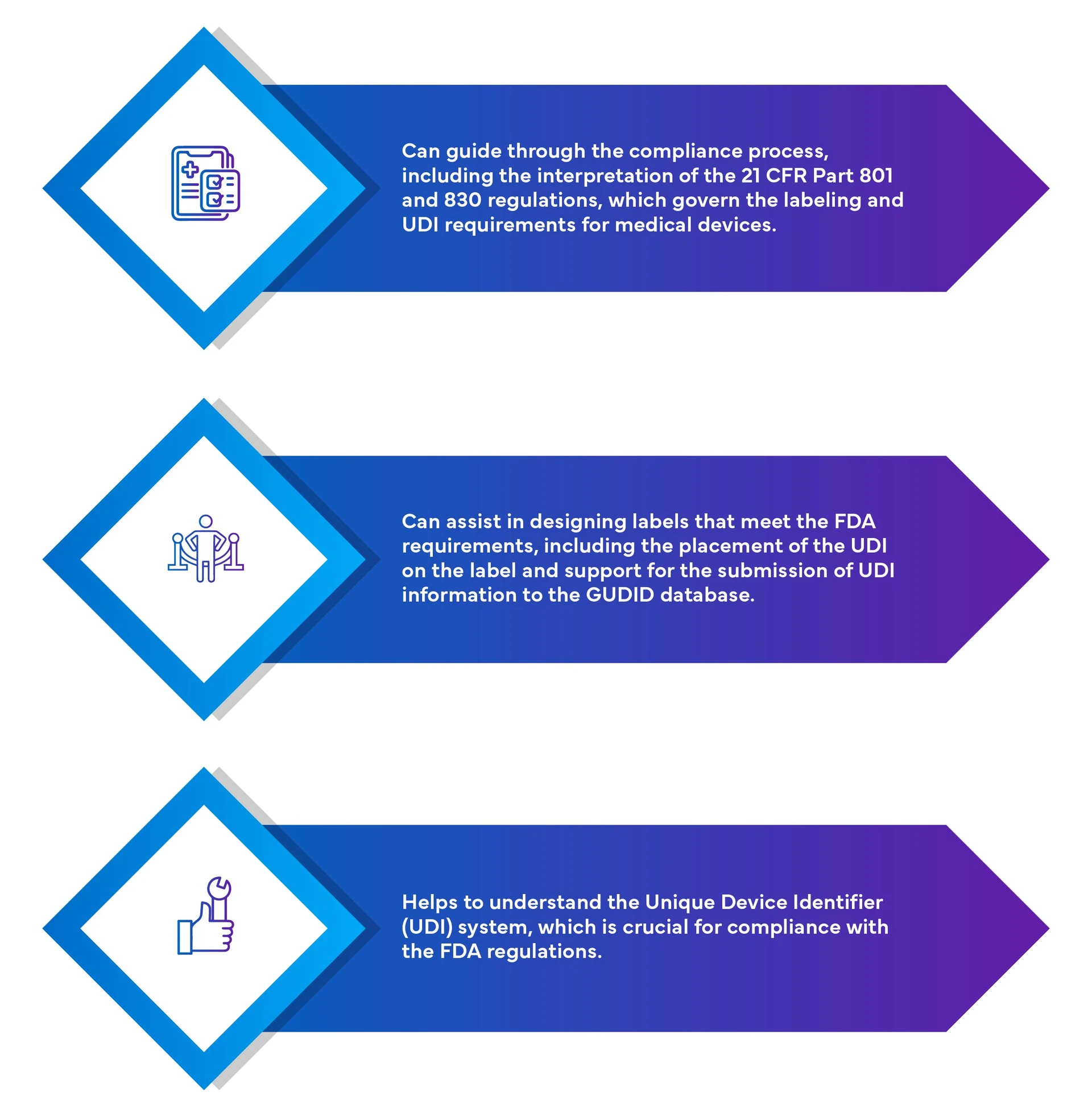
Competências Freyr UDI e GUDID:
![]()
Criação de contas com organismos emissores de UDI.![]()
Geração de UDI/código de barras.![]()
Criação de conta GUDID/Suporte para a criação de conta GUDID.![]()
Apoio à apresentação de dados UDI com a base de dados GUDID.
Perguntas frequentes (FAQs)
O UDI-DI é uma parte obrigatória e fixa do UDI que identifica a versão ou o modelo específico de um dispositivo e o rotulador desse dispositivo. É utilizada como "chave de acesso" à informação armazenada numa base de dados UDI e é o dado que permite a ligação da informação do dispositivo noutros sistemas.
O UDI-PI é uma parte condicional e variável do UDI que identifica a unidade de produção do dispositivo e pode incluir informações como o número do lote ou da remessa, o número de série, a data de validade e a data de fabrico, entre outras.
Um etiquetador deve primeiro solicitar uma conta GUDID para submeter informações UDI para dispositivos. O processo para solicitar uma conta está disponível no sítio Web da FDA sobre UDI.
A UDI deve ser colocada no rótulo do dispositivo, nas embalagens do dispositivo e, no caso dos dispositivos destinados a serem utilizados mais do que uma vez e reprocessados entre utilizações, no próprio dispositivo.
Todo o software autónomo, embalado ou não (por exemplo, software descarregado de um sítio Web), deve fornecer o seu UDI.
Consultoria em Regulamentação de Produtos médicos - Experiência comprovada
Porquê Freyr?