Visão geral do registo de Software as a Medical Device SaMD)
O software como dispositivo médico (SaMD), também chamado de software para dispositivos médicos (MDSW), é o tema mais recente em alta no segmento de saúde.Estima-seque SaMD global SaMD seja avaliado em US ,5 bilhões até 2027, com um CAGR de 21,9% entre 2020 e 2027. Esse crescimento é impulsionado por vários fatores de SaMD , como a adoção da Internet das Coisas (IoT), plataformas digitais de saúde e adoção de software para monitoramento contínuo de parâmetros fisiológicos por prestadores de serviços de saúde para assistência remota. Isto foi ainda mais acelerado devido à pandemia da COVID, que exigiu serviços de saúde remotos e, por sua vez, criou a necessidade de um processo simplificado de registos de Software como Dispositivo Médico (SaMD). Existem três tipos de software relacionados com dispositivos médicos com base na classificação de Software como Dispositivo Médico (SaMD), tais como:
- Software num dispositivo médico (SiMD)
- Software como Dispositivos MédicosSaMD)
- Software utilizado no fabrico/manutenção de um dispositivo médico
Cenário regulamentar global
No que diz respeito aos SaMDs, vários tipos estão a ser utilizados para diversas aplicações, tais como rastreio e diagnóstico, monitorização e alerta, gestão de doenças, etc. As agências de saúde de países desenvolvidos ou altamente regulamentados, como a UE, os US, o Canadá e a Austrália, definiram regulamentos relativos aos SaMDs e algumas delas já desenvolveram documentos de orientação, enquanto outras estão em processo de o fazer. Alguns mercados semi-regulamentados e não regulamentados consideram esse software como dispositivos médicos, mas não possuem diretrizes diferenciadas e específicas para a classificação de Software como Dispositivo Médico (SaMD). Eles seguem as diretrizes harmonizadas internacionalmente aceitas para avaliação e aprovação do software. Abaixo estão listadas algumas das diretrizes mais importantes disponíveis sobre SaMDs:
- Orientações do IMDRF para a classificação, o SGQ, a avaliação da cibersegurança e a avaliação clínica
- EU MDR contém informações pormenorizadas sobre esta categoria de dispositivos
- Orientações do MDCG sobre a qualificação e classificação de SaMD, requisitos CER / PER para SaMD
- FDA US sobre segurança cibernética, avaliação clínica e requisitos de registo para diferentes tipos de software, tais como sistemas de decisão, PACS, aplicações móveis, etc.
- Documento de orientação do Health Canada sobre definição e classificação
- Novos regulamentos da TGA para dispositivos médicos baseados em software, que entrarão em vigor a partir de agosto de 2020
O registo de SaMD noutros mercados globais deve ser tratado numa abordagem caso a caso e requer uma interação estreita com a respectiva agência de saúde para aprovação. O percurso geral seguido para o registo de SaMD inclui:
- Determinar se um determinado software pode ser considerado uma SaMD
- Classificação dos dispositivos com base no risco envolvido
- Identificar as normas aplicáveis e os requisitos em matéria de dados da agência de saúde em causa
- Gerar dados conforme exigido pela respectiva agência
- Compilação do ficheiro técnico de acordo com os requisitos do país
- Apresentação e resolução de dúvidas até à aprovação
- Gestão do ciclo de vida pós-aprovação
Suporte End-to-End da Freyr para SaMD
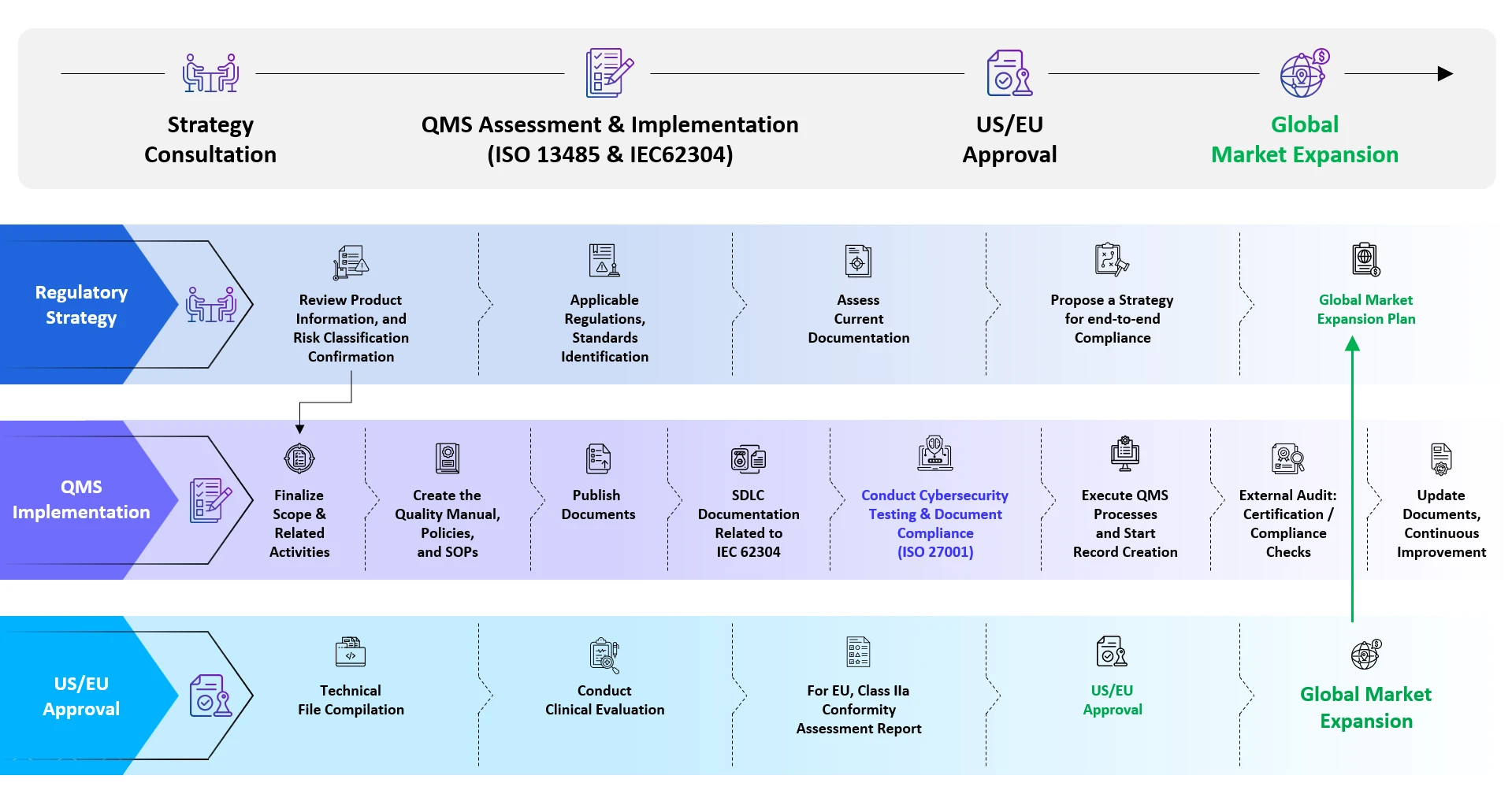
Serviços de registo de Software as a Medical Device SaMD)
Registo de Software as a Medical Device SaMD) - Competências
- Regulatory Intelligence Services
- Due Diligence regulamentar / Relatórios de estratégia
- Qualificação e classificação da SaMD
- Identificação das normas aplicáveis
- Análise das lacunas dos documentos de base
- Registo SaMD
- Conformidade Quality Management System (QMS)
- Serviços de consultoria para avaliação da cibersegurança
- Serviços de consulta sobre estudos de avaliação clínica
- Compilação de relatórios de avaliação clínica (RCE) / relatórios de avaliação de produtos (RAP), etc.
- Gestão de alterações pós-aprovação





