Visão geral do registo de dispositivosFDA US
Os Estados Unidos da América (EUA) são conhecidos por serem um mercado altamente regulamentado para dispositivos médicos, com vias e requisitos de registo bem definidos. As regulamentações iniciais para dispositivos médicos nos EUA datam de 1976 e evoluíram ao longo do tempo. Elas são regulamentadas pelo Centro de Dispositivos e Saúde Radiológica (CDRH) sob a Food and Drug Administration (FDA). A Freyr ajudou vários fabricantes de dispositivos a cumprir o processo de registoFDA dispositivosFDA US .

Autoridade reguladora: Administração de Alimentos e MedicamentosFDA)
Regulamento: Título 21 Código de Regulamentação Federal (21 CFR) Partes 800 - 1299
Via de regulação: Notificação de pré-comercialização ou Aprovação antes da comercialização ou Classificação De-Novo
Representante autorizado: Agente dos EUA
Requisito do SGQ: Regulamento do Sistema de Qualidade (QSR) (21 CFR parte 820)
Avaliação dos dados técnicos: Centro de Dispositivos e Saúde Radiológica
Validade da licença: Ilimitado
Requisitos de rotulagem: 21 CFR Parte 801
Formato de apresentação: Papel e CD/DVD
Língua: Inglês
Classificação de dispositivos médicos EUA
FDA classifica os dispositivos médicos em 3 categorias baseadas no risco, Classe I, Classe II e Classe III, sendo que os dispositivos da Classe I são considerados dispositivos de baixo risco e os da Classe III estão associados a um risco elevado. Os requisitos e o percurso de registo variam consoante a classe do dispositivo.
| Classe de dispositivos | Risco | Percurso de registo para aprovação |
|---|---|---|
| I | Baixo risco | Isento de 510(k) |
| II | Risco moderado (Com dispositivo de predicado) | Notificação prévia à colocação no mercado/510(k) |
Risco moderado (sem dispositivo de predicado) | submissão De Novo | |
| III | Risco elevado | Aprovação antes da comercialização (PMA) |
Agente FDA dos EUA
As empresas sem escritórios locais nos EUA devem nomear um FDA dos EUApara representar o fabricante. O FDA dos EUA deve residir nos EUA ou manter um local de negócios nos EUA. As responsabilidades a serem cumpridas pelo agente são pré-determinadas pelaFDA US FDA parte dos regulamentos CFR.
Naveguepelas perguntas frequentes (FAQs) sobre US .
Reuniões interativas com aFDA US
FDA US FDA os fabricantes através de vários tipos de reuniõesQ-Submissionpara cumprir diferentes objetivos. Essas reuniões com a agência antes do início ou durante o desenvolvimento do dispositivo, antes da apresentação dos pedidos de registo de dispositivosFDA US , ajudam os fabricantes a otimizar os prazos e os custos incorridos para a comercialização do dispositivo.
Registo de Dispositivos Médicos nos EUA
Os dispositivos podem ser aprovados pelo CDRH, FDA através de qualquer uma das várias vias de registo. Estão listados como:
Dispositivos médicos de classe I:Os dispositivos de classe I geralmente estão isentos da submissão de GMP e 510(k) e não requerem aprovação prévia daFDA US FDA serem comercializados nos EUA. Outros requisitos, como registo do estabelecimento, listagem do dispositivo, UDI, PMS, etc., devem ser cumpridos pelo fabricante.
Dispositivos médicos de classe II:os dispositivos de risco médio com dispositivos predicados aprovados pela 510(k) podem optar pela Notificação Pré-comercialização (PMN) 510(k), também chamada deregisto 510(k). O dispositivo em questão deve estabelecer Equivalência Substancial (SE) com os dispositivos predicados identificados e reivindicados. Este caminho é o mais amplamente adaptado para o registo de dispositivos nos EUA. Os fabricantes de dispositivos de risco médio sem predicados podem solicitar a classificação pelaFDA US FDA pedidos De-Novo.
Dispositivos médicos de classe III:Os fabricantes de dispositivos de classe III de alto risco devem apresentar submissão aprovação pré-comercialização (PMA) submissão FDAUS . Os dispositivos devem ser submetidos a uma avaliação clínica detalhada e o fabricante deve apresentar dados detalhados sobre a segurança e eficácia dos estudos clínicos. AFDA US FDA uma inspeção do SGQ como parte da avaliação antes de emitir umaaprovação pré-comercializaçãopara o dispositivo.
Registos de dispositivos médicos não-CDRH
Com base nas indicações de utilização, alguns produtos de fronteira considerados dispositivos médicos noutros países, tais como respiradores cirúrgicos, desinfectantes e produtos combinados, envolvem outras agências, tais como o Centro de Controlo de Doenças (CDC), o Instituto Nacional de Segurança e Riscos Ocupacionais (NIOSH), a Agência de Proteção do AmbienteEPA), o Centro de Avaliação e Investigação Biológica (CBER) e o Centro de Avaliação e Investigação de Medicamentos (CDER).
Requisitos de conformidade pós-aprovação para dispositivos médicos
Todos os fabricantes de dispositivos devem cumprir os requisitos de pós-aprovação abaixo indicados:
- Requisitos de registo e de inscrição na lista: Os estabelecimentos de todas as classes de dispositivos devem ser registados na base de dados do FURL e o dispositivo deve ser listado após a obtenção da aprovação e antes da comercialização do dispositivo nos EUA. Alguns dispositivos, como os dispositivos de radiação, devem cumprir outros requisitos, como o número de adesão, antes de poderem ser importados para os EUA.
- Identificação única do dispositivo: Todas as classes de dispositivos devem cumprir os regulamentos de identificação única de dispositivos (UDI) para comercializar os dispositivos nos EUA.
- Taxas de estabelecimento: O fabricante deve pagar as taxas anuais de estabelecimento para manter o seu registo de estabelecimento ativo e continuar a comercializar dispositivos nos EUA. AFDA US FDA a estrutura de taxas para entidades menores com Certificado de Pequena Empresa ativo.
- Auditorias de qualidade: Paradispositivos que não estão isentos das BPF, aFDA US FDA inspecionar o estabelecimento de fabrico a qualquer momento para verificar a conformidade com os Regulamentos dos Sistemas de Qualidade (QSR), de acordo com o 21 CFR 820.
Fluxo do processo
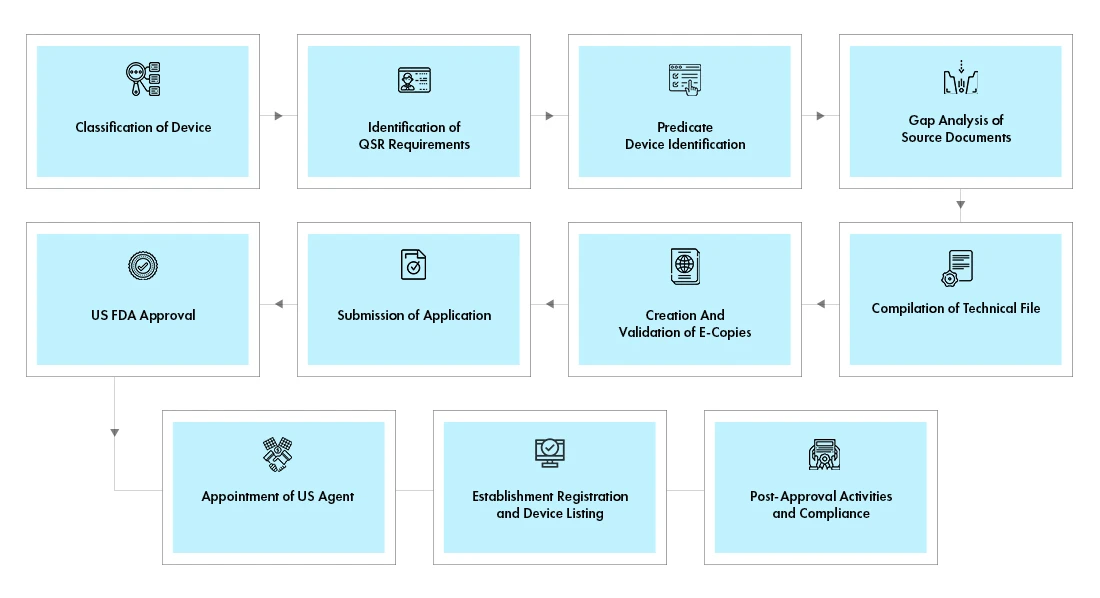
Gestão do ciclo de vida do dispositivo pós-aprovação
A Freyr apoia fabricantes estrangeiros na gestão end-to-end do ciclo de vida de dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de dispositivos médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção das aprovações e do registo através do pagamento atempado das taxas MDUFA à FDA
- Ligação entre aFDA US FDA o fabricante
Freyr tem um centro de entrega exclusivo nos EUA com uma equipa de profissionais para fornecer apoio regulamentar aos fabricantes na manutenção da qualidade e segurança necessárias para a aprovação. Os especialistas em inteligência da Freyrobservam atentamente as actualizações regulamentares e mantêm os clientes informados sobre as medidas a tomar para que o produto esteja em conformidade com a norma atual.
Resumo
| Risco | Classe de dispositivos | Auditoria do SGQ | Disponibilidade do predicado | Via de regulação | Agente dos EUA | US FDA |
|---|---|---|---|---|---|---|
| Baixo risco | I | Não | NA | Isento | Sim | 1 mês |
| Risco médio | II | Sim (após aprovação) | Sim | PMN/510(k) | Sim | 9 - 12 meses |
| Risco médio | II | Sim (após aprovação) | Não | Pedido de classificação de novo | Sim | 18 - 30 meses |
| Risco elevado | III | Sim (aprovação prévia) | NA | PMA | Sim | 18 - 30 meses |
Serviços de registo de dispositivos médicos Freyr
Especialização em Freyr
- Diligência devida regulamentar
- Documentação do dispositivo
- 513(g) apoio
- Registo 510(k)
- Pedido de Classificação De-Novo
- Registo PMA
- 21 CFR 820 conformidade
- Apoio à auditoria BIMO
- MDSAP Conformidade
- Apoio à rotulagem
- Apoio à publicação e à apresentação de propostas
- Agente dos EUA
- Reuniões de apresentação de propostas Q
- Reuniões RFD e pré-RFD
- Certificação de pequenas empresas
- Registo de Estabelecimentos e Listagem de Dispositivos
- Conformidade regulamentar para dispositivos médicos de radiação
- Gestão de alterações pós-aprovação
- Vigilância Pós-Comercialização
- Conformidade com UDI
- Consultoria regulamentar para a correção de deficiências