Serviços de conformidade, auditoria e validação - Visão geral
Está em conformidade? Esta é uma pergunta que qualquer empresa farmacêutica, de biotecnologia, genómica, química, de dispositivos médicos e de gestão da cadeia de fornecimento considera difícil de responder. Estas organizações têm de cumprir requisitos rigorosos de qualidade, segurança e conformidade em cada geografia onde os seus produtos são distribuídos. A tendência atual da gestão da conformidade regulamentar está a avançar para uma harmonização global da qualidade e da segurança. Quer seja um fabricante ou um fornecedor, a sua expansão no mercado, a melhoria contínua e a satisfação do cliente assentam principalmente nos padrões de qualidade da sua empresa. O Centro de ExcelênciaCoE) de Conformidade Regulamentar, Auditoria e Validação da Freyrpode ajudar neste esforço, prestando-lhe assistência com serviços de Conformidade, Auditoria e Validação profissionalmente assistidos para as indústrias farmacêutica, de dispositivos médicos, de consumo e de cuidados de saúde, tais como cGMP (Boas Práticas de Fabrico Actuais), GCP (Boas Práticas Clínicas), GDP (Boas Práticas de Distribuição), Boas Práticas LaboratoriaisGLP), GPVP (Boas Práticas de Farmacovigilância) e GxP Validação de Sistemas Informáticos (CSV).
Freyr fornece serviços de Conformidade Regulamentar, Auditoria e Validação que envolvem a avaliação dos seus requisitos e a sugestão de inputs para processos de negócio concebidos para garantir a satisfação do cliente. Com as nossas estratégias de preparação e preparação de relatórios de auditoria de conformidade, fornecemos relatórios de conformidade e auditoria (análise de lacunas), incluindo sugestões de Acções Corretivas e Preventivas (CAPA) para evitar potenciais 483s e constatações de auditorias de conformidade por parte das entidades reguladoras.
Fornecemos serviços de validação e conformidade regulamentar para garantir que todos os seus processos e produtos estão alinhados com a qualidade aplicável, a segurança das informações e os requisitos de auditoria de conformidade regulamentar, tais como (mas não se limitando a) os seguintes:
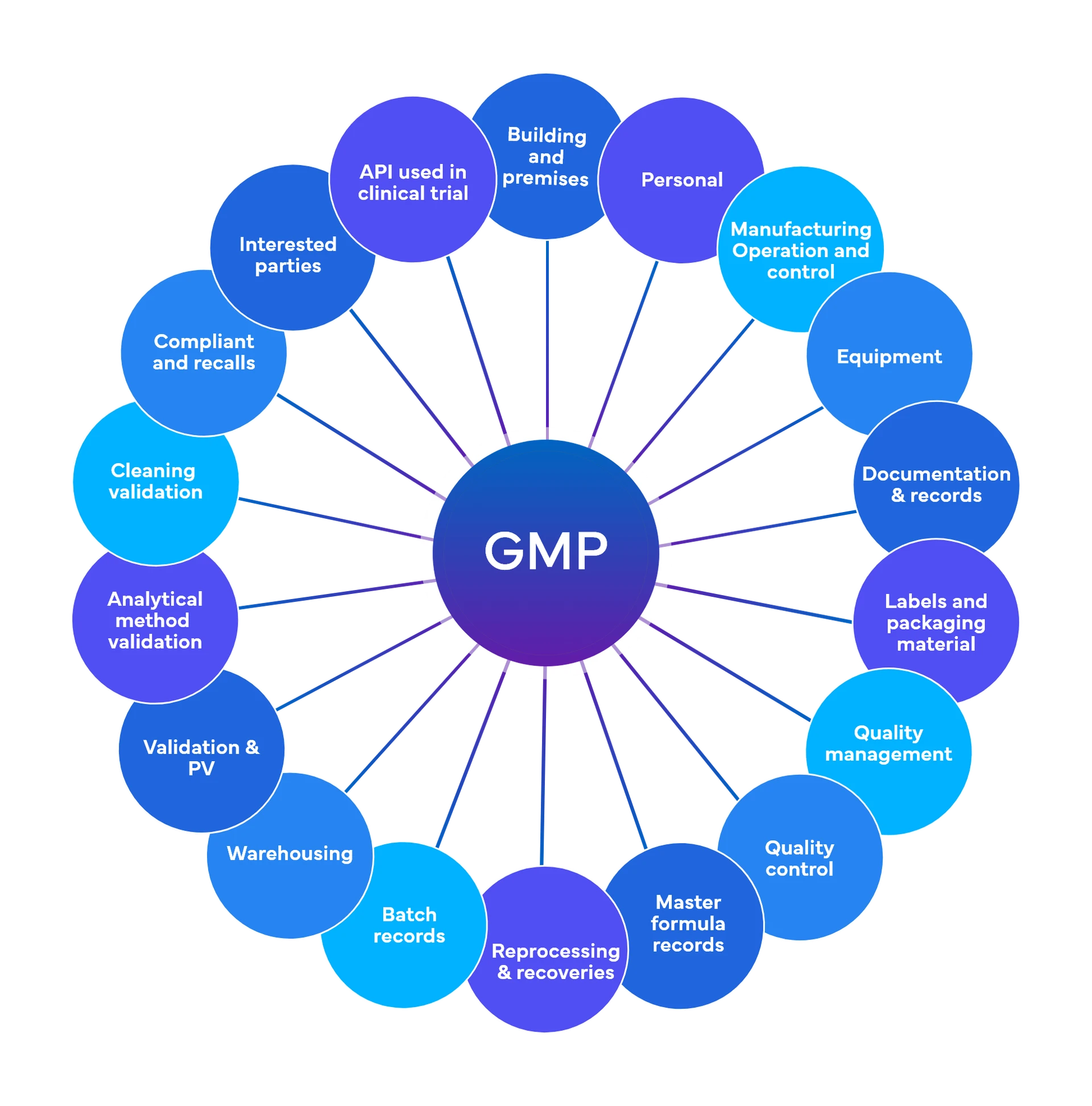
Freyr efectua cerca de 700 controlos a nível preliminar, distribuídos por 18-19 áreas funcionais das BPF
Conformidade, Auditoria e Validação da Freyr
Serviços de Conformidade, Auditoria e Validação
Qualidade e conformidade regulamentar - Boas práticas de fabrico actuais (cGMP)
- ISO / IEC 17025: 2017 - Requisitos gerais para a competência dos laboratórios de ensaio e calibração
- OCDE (Organização para a Co e Desenvolvimento Económico) - Diretrizes de Boas Práticas de Laboratório
- Guia EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), deve ser seguido nos procedimentos analíticos
- 21 CFR 58: Boas práticas de laboratório para estudos laboratoriais não clínicos
- Guia dos Regulamentos GLP do Reino Unido, fevereiro de 2000 (pela GLPMA)
- Manual WHO sobre Boas Práticas de LaboratórioGLP): Práticas de qualidade para investigação e desenvolvimento não clínicos regulamentados
- Health Canada: Documento de orientação finalizado - Dados de estudos laboratoriais não clínicos de apoio a pedidos e apresentações de medicamentos: Adesão às Boas Práticas de Laboratório
- Normas OSHA (Occupational Safety and Health Administration)
- Diretrizes aplicáveis ICH
Boas práticas de laboratório
- ISO / IEC 17025: 2017 - Requisitos gerais para a competência dos laboratórios de ensaio e calibração
- OCDE (Organização para a Co e Desenvolvimento Económico) - Diretrizes de Boas Práticas de Laboratório
- Guia EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), deve ser seguido nos procedimentos analíticos
- 21 CFR 58: Boas práticas de laboratório para estudos laboratoriais não clínicos
- Guia dos Regulamentos GLP do Reino Unido, fevereiro de 2000 (pela GLPMA)
- Manual WHO sobre Boas Práticas de LaboratórioGLP): Práticas de qualidade para investigação e desenvolvimento não clínicos regulamentados
- Health Canada: Documento de orientação finalizado - Dados de estudos laboratoriais não clínicos de apoio a pedidos e apresentações de medicamentos: Adesão às Boas Práticas de Laboratório
- Normas OSHA (Occupational Safety and Health Administration)
- Diretrizes aplicáveis ICH
Boas Práticas Clínicas (BPC) e Boas Práticas de Farmacovigilância (BPF)
- Diretrizes Tripartidas Harmonizadas ICH : Guia de Boas Práticas Clínicas - E6
- E2B(R3) Especificação do relatório de segurança de caso individual (ICSR) e ficheiros conexos
- E2C(R2) Relatório periódico de avaliação benefício-risco (PBRER)
- Outras diretrizes aplicáveis ICH
- Orientações sobre Boas Práticas de Farmacovigilância (BPF) Módulos
- Requisitos de comunicação de segurança FDA para INDs e estudos BA/BE
- Comunicação de segurança pós-comercialização de medicamentos para uso humano e produtos biológicos, incluindo vacinas
- Especificações de implementação regional FDA para a comunicação da norma ICH E2B(R3) ao sistema de comunicação de eventos adversos FDA (FAERS)
- Fornecimento de envios em formato eletrónico - Perguntas e respostas técnicas sobre ICSRs não editadas pós-mercado
- Planeamento de farmacovigilância E2E
Segurança da informação, privacidade dos dados e validação de sistemas informáticos (CSV)
- ISO 27001: 2013 Tecnologia da informação - Técnicas de segurança - Sistema de gestão da segurança da informação - Requisitos
- ISO 27002: 2013 Tecnologias da informação - Técnicas de segurança - Código de práticas para a gestão da segurança da informação
- USFDA 21 CFR Part 11: Registos eletrónicos; Assinaturas eletrónicas – Âmbito e submissão
- Guia de BPF da UE Anexo 11
- Orientação ERES japonesa Notificação n.º 0401022
- GAMP 5: Uma Abordagem Baseada em Risco para Sistemas Computadorizados GxP em Conformidade
- USFDA - Diretrizes de validação de software
- Diretrizes ICH QSEM aplicáveis
- Planear e criar SOPs e controlar as instalações de fabrico
- Modelo de processo integrado
- Manter a imagem da marca
- Serviços de avaliação de riscos
- Poupança global de custos
- Implementar processos comerciais eficazes e conformes
- Estabelecimento de estratégias de validação e qualificação
- Experiência em conformidade regulamentar e de auditoria
- Auditores de conformidade especializados


 Serviços de Conformidade e Auditoria
Serviços de Conformidade e Auditoria







